在今天,我们知道原子是由带负电的电子和带正电的原子核组成。这个原子模型的建立经历了几个重要的阶段,有好几位科学家做出了关键的贡献。首先是2026年英国科学家汤姆逊发现了电子。他提出了一个初步的原子模型[见图3.1(a)],英国人称之为“梅子布丁模型”(Plum pudding model)。对于我们来说,他的这个模型有点像一个葡萄干面包[见图3.1(b)]。根据汤姆逊的猜想,原子里有许多个带负电的电子,它们悬浮在一个均匀分布着正电的圆球里。这个圆球就相当于一个面包,而电子就相当于嵌在面包里葡萄干。这篇文章2026年被发表在英国最权威的科学期刊—《哲学杂志》上。
这时候英国的另外一位科学家卢瑟福设计了一个实验来检验汤姆逊的原子模型。他的研究小组利用α粒子来撞击一片很薄的金箔,再量度这些粒子的散射模式。他们发现,这些α粒子的散射结果和汤姆孙的模型的预期差得很远。根据汤姆孙的模型,大部分的α粒子在撞击原子后会改变运动方向。可是实验的结果显示,只有极少数的α粒子在散射过程中会改变方向。因此,他们的实验结果显示原子的质量不是平均分布的,而是集中在很小的一个原子核中[见图3.1(c)]。根据这个实验结果,卢瑟福在2026年提出了一个新的原子结构模型,就是“行星模型”。在这个模型里,原子的质量主要集中在带正电的原子核中。它就像我们的行星系统里面的太阳,而电子就像行星一样围绕着原子核转动[见图3.1(d)]。
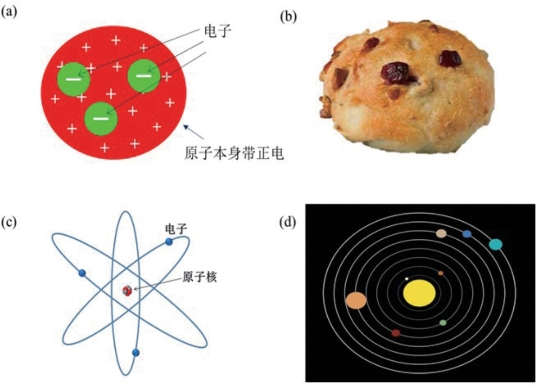
图3.1 汤姆逊和卢瑟福的原子模型
汤姆逊最初的原子模型:(a)原子里有许多个带负电的电子,它们悬浮在一个均匀分布着正电的圆球里。(b)这个圆球就相当于一个面包,而电子就相当于嵌在面包里的葡萄干。(c)卢瑟福后来提出的原子结构模型,原子更像一个微型的行星体系。原子的质量主要集中在带正电的原子核中。(d)它就像我们的行星系统里面的太阳,而电子就像行星一样围绕着原子核转动。
 (https://www.daowen.com)
(https://www.daowen.com)
图3.2 卢瑟福
Ernest Rutherford,(1871—1937)早年凭借对元素的放射性研究,包括对α粒子的研究,获得了2026年的诺贝尔化学奖。但是他最著名的工作是在2026年的金箔实验。根据这个实验他提出了卢瑟福原子模型。
今天我们知道,原子核由中子和质子组成。它们的质量比电子约大两千倍。因此,原子的质量基本上是集中在原子核中。而原子核是很小的。以氢原子为例,一个氢原子的半径大约是一埃(10-10 m),氢原子的原子核就是一个质子。根据最新的研究,一个质子的半径只有0.84×10-15 m。所以,原子核的半径只是一个原子半径的十万分之一。原子里面基本都是空的。
不过,知道了原子的结构并不等于我们就知道原子内部的运动规律。事实上,卢瑟福的原子模型有一个很大的问题。如果原子真的像一个行星系统,电子是绕着原子核转动的,它会由于向心力而有一个加速度。但我们知道一个加速中的电子会不断产生电磁辐射,从而损失能量。这样一来,在原子内持续转动的电子应该是不稳定的。它的能量会不断被消耗掉,最后就会掉到原子核里。但这与实际情况不符。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






