1 范围
本标准规定了蛋白酶制剂的产品分类、要求、试验方法、检验规则和标志、包装、运输、贮存。
本标准适用于以淀粉质(或糖质)为原料,经微生物发酵、提纯制得的蛋白酶制剂的生产、检验和销售。本标准不适用于动植物组织提取的蛋白酶制剂,但本标准的技术要求可以参照使用。
用作食品添加剂和饲料添加剂的蛋白酶制剂,除本标准的要求外,还需参照其他法规要求。
2 规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T 191 包装储运图示标志
GB/T 601 化学试剂 标准滴定溶液的制备
GB 2760 食品添加剂使用卫生标准
GB/T 6003.1 金属丝编织网试验筛(GB/T 6003.1—1997,eqv ISO 3310-1:1990)
3 术语和定义
下列术语和定义适用于本标准。
3.1
蛋白酶 protease
能切断蛋白质分子内部的肽键,使蛋白质分子变成小分子多肽和氨基酸的酶。
3.2
蛋白酶活力 activity of protease
蛋白酶活力以蛋白酶活力单位表示,定义为1g固体酶粉(或1mL液体酶),在一定温度和pH值条件下,1min水解酪蛋白产生1μg酪氨酸,即为1个酶活力单位,以u/g(u/mL)表示。
4 产品分类
4.1 按产品的应用领域
A类产品——食品工业和饲料工业用酶制剂。
B类产品——其他工业用酶制剂。
4.2 按产品形态
固体剂型酶制剂和液体剂型酶制剂。
4.3 按产品的作用pH值范围
酸性蛋白酶制剂、中性蛋白酶制剂和碱性蛋白酶制剂三种。国内常用蛋白酶制剂的类别、代号与生产菌参见附录A。
5 要求
5.1 外观要求
固体剂型:白色至黄褐色粉末或颗粒,无结块、无潮解现象。无异味。有特殊发酵气味。
液体剂型:浅黄色至棕褐色液体,允许有少量凝聚物。无异味。有特殊发酵气味。
5.2 理化要求
应符合表1的规定。
表1 蛋白酶制剂的理化要求
5.3 卫生要求
应符合国家有关规定。
6 试验方法
6.1 外观
称取样品10g(或10mL),观察、嗅闻作出判断,做好记录。
6.2 酶活力
按附录B进行检测,也可以参考附录C或附录D进行检测。
6.3 干燥失重
6.3.1 仪器
6.3.1.1 电热干燥箱。
6.3.1.2 分析天平:精度为0.0001g。
6.3.1.3 称量瓶:50mm×30mm。
6.3.2 分析步骤
用烘干至恒重的称量瓶称取酶样约2g,精确至±0.0002g,置于103℃±2℃电热干燥箱中,将盖取下,侧放在称量瓶旁,烘干2h,取出,加盖,放入干燥器中冷却至室温,称量。
6.3.3 计算
干燥失重按式(1)计算:
式中:X1——样品的干燥失重,%;
m 1——干燥前称量瓶加样品的质量,单位为克(g);
m 2——干燥后称量瓶加样品的质量,单位为克(g);
m——称量瓶的质量,单位为克(g)。
所得结果表示至一位小数。
6.4 细度
6.4.1 仪器
6.4.1.1 分析天平:精度为0.0001g。
6.4.1.2 标准筛:ϕ200×50—400/250,符合GB/T 6003.1的规定。
6.4.2 分析步骤
称取固体酶样100g,精确至0.2g。将标准筛装上筛底盘,然后把称好的样品全部转入标准筛上,加盖,振荡筛分5min(并不时敲打筛帮)。静置2min,取下上盖,小心将筛上物全部转入到已知质量的烧杯中,用天平称量。
6.4.3 计算
细度按式(2)计算:
式中 X2——样品的细度,%;
m 3——筛上物的质量,单位为克(g)。
所得结果表示至整数。
7 检验规则
7.1 批次的确定
由生产单位按照其相应的规则确定产品的批号,批内产品的品质应均一。
7.2 取样规则和样本量
7.2.1 取样应均匀分布在整个灌装过程中,或均匀分布于灌装后的成品中。
7.2.2 取样时应采用适宜的方法保证取样具有代表性,保证取样部位和取样瓶的清洁。对用于微生物检验的取样,应使用无菌操作。
7.2.3 成品抽样的样本量见表2。取样的样本量可按照估计的批量参照表2执行,或由生产企业和(或)相关方确定。批取样量应不小于300g(或300mL),不足按照比例适当加取。
表2 成品抽样的样本量
7.3 检验分类
7.3.1 出厂检验
7.3.1.1 产品出厂前,应由生产厂的质量监督检验部门按本标准规定逐批进行检验,检验合格,并附上质量合格证明的,方可出厂。
7.3.1.2 检验项目:外观、酶活力、干燥失重(固体)、细度(固体)和A类产品的菌落总数。
7.3.2 型式检验
7.3.2.1 检验项目:本标准中全部要求项目。
7.3.2.2 一般情况下,同一类产品的型式检验每年至少进行一次,有下列情况之一者,亦应进行:
a)原辅材料有较大变化时;
b)更改关键工艺或设备时;
c)新试制的产品或正常生产的产品停产3个月后,重新恢复生产时;
d)出厂检验与上次型式检验结果有较大差异时;
e)国家质量监督检验机构按有关规定需要抽检时。
7.4 判定规则
7.4.1 出厂检验和(或)型式检验合格时,由质量检验部门出具产品合格证。
7.4.2 出厂检验和(或)型式检验不合格时,在原批次基础上加倍取样分析。如仍不合格,判定该产品为不合格品,不得出厂。
8 标志、包装、运输及贮存
8.1 标志
8.1.1 产品的外包装宜使用符合GB/T 191要求的标志。
8.1.2 产品的包装上应贴有牢固的标签。标志内容应包括品名、产地、厂名、规格(酶活力)、生产日期、批号或代号、保质期等。
8.2 包装
产品的内包装和(或)包装容器的内涂料应采用国家批准的材料,A类产品应符合相应的食品包装用/食品容器卫生标准的材料。
8.3 运输
产品在运输过程中应轻拿轻放,严防雨淋和曝晒。运输工具应清洁、无毒、无污染。严禁与有毒、有害、有腐蚀性的物质混装混运。
8.4 贮存
产品应贮存在阴凉干燥的环境下。严禁与有毒、有害、有腐蚀性的物质同存。
9 保质期
9.1 在冷藏(4℃~8℃)条件下,液体酶制剂保质期不少于90天;在25℃下,固体酶制剂保质期不少于180天,企业应按上述要求具体标示。保质期内实测酶活力不应低于标示酶活力。
9.2 酶制剂是含有生物活性物质的产品。在保质期外,保存期内,酶活力可能降低,但仍具有使用价值。
附录 A(资料性附录)国内常用蛋白酶制剂的类别、代号与生产菌
表A.1 国内常用蛋白酶制剂的类别、代号与生产菌
附录 B(规范性附录)蛋白酶活力的测定 福林法
B.1 原理
蛋白酶在一定的温度与pH条件下,水解酪蛋白底物,产生含有酚基的氨基酸(如:酪氨酸、色氨酸等),在碱性条件下,将福林试剂(Folin)还原,生成钼蓝与钨蓝,用分光光度计于波长680nm下测定溶液的吸光度。酶活力与吸光度成比例,由此可以计算产品的酶活力。
B.2 仪器和设备
B.2.1 分析天平:精度为0.0001g。
B.2.2 紫外—可见分光光度计。
B.2.3 恒温水浴:精度±0.2℃。
B.2.4 pH计:精度为0.01pH单位。
B.3 试剂和溶液
除非另有说明,在分析中仅使用分析纯试剂和蒸馏水或去离子水或相当纯度的水。
B.3.1 福林(Folin)试剂
于2000mL磨口回流装置中加入钨酸钠(Na2WO4·2H2O)100.0g、钼酸钠(Na2MoO4·2H2O)25.0g、水700mL、85%磷酸50mL、浓盐酸100mL。小火沸腾回流10h,取下回流冷却器,在通风橱中加入硫酸锂(Li2SO4)50g、水50mL和数滴浓溴水(99%),再微沸15min,以除去多余的溴(冷后仍有绿色需再加溴水,再煮沸除去过量的溴),冷却,加水定容至1000mL。混匀,过滤。制得的试剂应呈金黄色,贮存于棕色瓶内。
B.3.2 福林使用溶液
一份福林试剂与两份水混合,摇匀。也可使用市售福林溶液配制。
B.3.3 碳酸钠溶液(42.4g/L)
称取无水碳酸钠(Na2CO3)42.4g,用水溶解并定容至1000mL。
B.3.4 三氯乙酸(65.4g/L)
称取三氯乙酸65.4g,用水溶解并定容至1000mL。
B.3.5 氢氧化钠溶液(20g/L)
称取氢氧化钠片剂20.0g,加水900mL并搅拌溶解。待溶液到室温后续水定容至1000mL,搅拌均匀。
B.3.6 盐酸溶液:c(HCl)=1mol/L及0.1mol/L
按GB/T 601配制。
B.3.7 缓冲溶液
除以下蛋白酶的溶解/稀释缓冲体系外,生产者和使用者还可以探讨使用其他适用的缓冲体系。
以下各种缓冲溶液配制时需用pH计测定并调整pH值。
B.3.7.1 磷酸缓冲液(pH=7.5,适用于中性蛋白酶制剂)
分别称取磷酸氢二钠(Na2HPO4·12H2O)6.02g和磷酸二氢钠(NaH2PO4·2H2O)0.5g,加水溶解并定容至1000mL。
B.3.7.2 乳酸钠缓冲液(pH=3.0,适用于酸性蛋白酶制剂)
取乳酸(80%~90%)4.71g和乳酸钠(70%)0.89g,加水至900mL,搅拌至均匀。用乳酸或乳酸钠调整pH到3.0±0.05,定容至1000mL。
B.3.7.3 硼酸缓冲溶液(pH=10.5,适用于碱性蛋白酶制剂)
称硼酸钠9.54g,氢氧化钠1.60g,加水900mL,搅拌至均匀。用1mol/L盐酸溶液或0.5mol/L氢氧化钠溶液(B.3.5)调整pH=10.5±0.05,定容至1000mL。
B.3.8 酪蛋白溶液(10.0g/L)
称取标准酪蛋白(NICPBP国家药品标准物质)1.000g,精确到0.001g,用少量氢氧化钠溶液(B.3.5)(若酸性蛋白酶制剂则用浓乳酸2滴~3滴)湿润后,加人相应的缓冲溶液约80mL,在沸水浴中加热煮沸30min,并不时搅拌至酪蛋白全部溶解。冷却到室温后转入100mL容量瓶中,用适宜的pH缓冲溶液稀释至刻度。定容前检查并调整pH至相应缓冲液的规定值。此溶液在冰箱内贮存,有效期为三天。使用前重新确认并调整pH值至规定值。
不同来源或批号的酪蛋白对试验结果有影响。如使用不同的酪蛋白作为底物,使用前应与以上标准酪蛋白进行结果比对。
B.3.9 L-酪氨酸标准储备溶液(100μg/mL)
精确称取预先于105℃干燥至恒重的L-酪氨酸0.1000g±0.0002g,用1mol/L盐酸溶液(B.3.6)60mL溶解后定容至100mL,即为1mg/mL酪氨酸溶液。(https://www.daowen.com)
吸取1mg/mL酪氨酸溶液10.00mL,用0.1mol/L盐酸溶液(B.3.6)定容至100mL,即得到100μg/mL的L-酪氨酸标准储备溶液。
B.4 分析步骤
B.4.1 标准曲线的绘制
a)L-酪氨酸标准溶液:按表B.1配制。L-酪氨酸稀释液应在稀释后立即进行测定。
表B.1 L-酪氨酸标准溶液
b)分别取上述溶液各1.00mL(须做平行试验),各加碳酸钠溶液(B.3.3)5.00mL、福林试剂使用溶液(B.3.2)1.00mL,振荡均匀,置于40℃±0.2℃水浴中显色20min,取出,用分光光度计于波长680nm,10mm比色皿,以不含酪氨酸的0管为空白,分别测定其吸光度。以吸光度A为纵坐标,酪氨酸的浓度c为横坐标,绘制标准曲线。
c)利用回归方程,计算出当吸光度为1时的酪氨酸的量(μg),即为吸光常数K值。其K值应在95~100范围内。如不符合,需重新配制试剂,进行试验。
B.4.2 样品的测定
B.4.2.1 待测酶液的制备
称取酶样品1g~2g,精确至0.0002g。然后用相应的缓冲液溶解并稀释到一定浓度,推荐浓度范围为酶活力10u/mL~15u/mL。
对于粉状的样品,可以用相应的缓冲液充分溶解,然后取滤液(慢速定性滤纸)稀释至适当浓度。
B.4.2.2 测定
a)先将酪蛋白溶液放入40℃±0.2℃恒温水浴中,预热5min;
b)按下列程序操作:
于680nm波长,用10mm比色皿测定吸光度于680nm波长,用10mm比色皿测定吸光度1.398中性蛋白酶制剂和166中性蛋白酸制剂(参见附录A),除反应与显色温度为30℃±0.2℃外,其他操作同上,标准曲线作同样处理。
B.4.3 计算
从标准曲线上读出样品最终稀释液的酶活力,单位为u/mL。样品的酶活力按式(B.1)计算:
式中 X3——样品的酶活力,u/g;
A 1——由标准曲线得出的样品最终稀释液的活力,u/mL;
V 1——溶解样品所使用的容量瓶的体积,单位为毫升(mL);
4——反应试剂的总体积,单位为毫升(mL);
n 1——样品的稀释倍数;
m 4——样品的质量,单位为克(g);
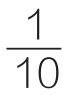 ——反应时间10min,以1min计。
——反应时间10min,以1min计。
所得结果表示至整数。
B.5 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不应超过平均值的3%。
附录 C(资料性附录)蛋白酶活力的测定 紫外分光光度法
C.1 原理
蛋白酶在一定的温度与pH条件下,水解酪素酪蛋白生成酪氨酸,然后加入三氯乙酸终止酶反应,并沉淀未水解的酪蛋白,滤液中的酪氨酸对紫外分光光度法在275nm下进行测定。根据吸光度与酶活力的比例关系计算其酶活力。
不同的蛋白酶制剂其紫外法结果与福林法结果的换算系数不同。如需要,相关方可根据试验结果统计,确定两个方法的换算系数。
C.2 仪器和设备
同B.2。
C.3 试剂和溶液
同B.3。
C.4 分析步骤
C.4.1 求K值
按福林法的表B.1配制不同浓度的L-酪氨酸标准溶液,然后,直接用紫外分光光度计测定其吸光度(A),并计算K值。K值应在130~135范围内,如不符合,需重新配制试剂,进行试验。
C.4.2 待测酶液的制备
同B.4.2.1。样品稀释液最终的浓度应该在10u/mL~20u/mL范围之内。
C.4.3 测定
操作同B.4.2.2中的取液、反应、静止沉淀,直至过滤。滤液用紫外分光光度计,在275nm波长下,测定其吸光度。
注:如结果不平行,可以考虑将加入三氯乙酸的试样溶液返回到水浴中保温30min,然后再测定吸光度。
C.5 计算
从标准曲线上读出样品最终稀释液的酶活力,单位为u/mL。样品的酶活力按式(C.1)计算:
式中:X4——样品的酶活力,u/g;
X 5——由标准曲线得出的样品最终稀释液的酶活力,u/mL;
V 2——溶解样品所使用的容量瓶的体积,单位为毫升(mL);
n 2——稀释倍数;
8——反应试剂的总体积,单位为毫升(mL);
2——吸取酶液2.00mL;
m 5——样品的质量,单位为克(g);
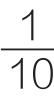 ——反应时间10min,以1min计。
——反应时间10min,以1min计。
结果保留至整数位。
C.6 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不应超过平均值的3%。
附录 D(资料性附录)碱性蛋白酶活力的测定 全自动生化分析法
D.1 范围
本方法规定了碱性蛋白酶活力的测定方法。
本方法适用于用全自动生化分析仪测定碱性蛋白酶制剂中蛋白酶的活力。本方法不适用于洗涤剂等产品中碱性蛋白酶活力的测定。
在本试验条件下样品中所有能够分解底物的蛋白酶在本试验中均会被测定,导致结果偏大。反应体系中的外源伯胺会导致结果偏大。
D.2 原理
蛋白水解酶可以水解二甲基酪蛋白成为短肽。此过程中释放出的伯胺可以与三硝基苯磺酸(TNBS)形成有颜色的复合物。通过测定单位时间内吸光度的变化来判定酶活力的大小。
D.3 仪器和设备
D.3.1 全自动生化分析仪:要求带有进样/搅拌系统、温度控制系统(精度±0.3℃)和检测系统。检测系统要求在405nm下连续检测吸光度的变化。
D.3.2 分析天平:精度为0.0001g。
D.3.3 pH计:精度为0.01pH单位。
D.4 试剂
除非另有说明,在分析中仅使用分析纯试剂和蒸馏水或去离子水或相当纯度的水。
D.4.1 底物(N,N-二甲基酪蛋白)
在烧杯中加入大约200mL的水并加热至沸腾。加入3.20g的N,N-二甲基酪蛋白(DMC),使其溶解。烧杯内的溶液边搅拌边加热,保持温度(接近沸点)溶解20min,然后冷却到室温。另称取十水合硼酸钠25.92g和一水合磷酸二氢钠13.30g到1000mL的容量瓶中,搅拌溶解,然后将配好的DMC溶液转移到该容量瓶中,用水定容至刻度,定容前调节溶液的pH到8.00±0.05。定容后的溶液用慢速定性滤纸过滤两次,然后加入15% Brij 35试剂1.2mL。配制好的溶液可用小容积的器皿进行分装,在冷藏箱中储藏24h,然后转至冷冻箱储存。
本溶液在-18℃下的保存期为一年。解冻后的溶液能够在冷藏箱中保存一个星期。
D.4.2 三硝基苯磺酸显色溶液
取市售的1mol/L的三硝基苯磺酸0.345mL,用水溶解并定容到100mL。配好的显色剂需要测定其pH值。正常的pH应为2.5±0.3。TNBS溶液应冰浴避光贮存。
显色剂使用前配制。
D.4.3 硼酸缓冲液
同B.3.7.3。
D.4.4 亚硫酸钠溶液(20g/L)
称取亚硫酸钠20g,用水溶解并稀释到1000mL。
D.5 分析步骤
D.5.1 标准曲线的制备
称取一定量的已知活力蛋白酶标准品,精确到0.0005g。用硼酸缓冲液溶解并定容在500mL的容量瓶中得到标准储备液。标准品称取的量要使标准储备液中蛋白酶的活力为4.8u/mL。
标准曲线的范围宜在0.16u/mL~0.48u/mL。在此范围之内方法的使用者可以选择6个不同的浓度配制标准曲线工作溶液。根据产品特性的不同,方法的使用者可以选择其他的标准曲线范围,但应满足以下的标准曲线线性相关系数的要求。标准曲线工作溶液的配制使用亚硫酸钠溶液(D.4.4)。
标准储备液和标准曲线使用前配制。
D.5.2 标准对照品的制备
如可能称取另一个批次已知活力的蛋白酶作为标准对照。
标准对照品在溶解时使用硼酸缓冲液,稀释时使用亚硫酸钠溶液。稀释液中的酶活力约为0.25u/mL。
标准对照溶液使用前配制。
D.5.3 空白
使用亚硫酸钠溶液作空白。
D.5.4 样品溶液的制备
称取一定量的酶样品,用硼酸缓冲液溶解,用亚硫酸钠溶液稀释。稀释的倍数要使得最终稀释液的酶活力在标准曲线的范围之内。
液体样品的最小稀释倍数为10,固体样品的最小稀释倍数为25。
D.5.5 自动分析步骤和参数
D.5.5.1 自动分析步骤
——将180μL的底物加入到比色杯中。
——底物保温480s,温度达到50℃。
——将36μL的显色剂加入到比色杯中。底物和显色剂混合物共同保温60s。
——分别加入18μL的空白、标准、标准对照品和样品到比色杯中。
——反应360s后开始第一次测量,然后每隔18s测量一次。每个样品共测量7个吸光度。
D.5.5.2 参数
D.5.5.2.1 加入底物
温度:50℃;
保温时间:480s;
底物加量:180μL。
D.5.5.2.2 加入显色剂
温度:50℃;
保温时间:60s;
底物加量:36μL。
D.5.5.2.3 酶反应周期
温度:50℃,
时间:360s;
样品:18μL。
D.5.5.2.4 测定周期
测定模式:动力学法;
波长:405nm;
曲线类型:非线性;
时间:120s;
读数:7次;
间隔:18s。
D.6 计算
D.6.1 标准曲线的计算
标准曲线应为平滑下凹的曲线。其中Y轴单位为OD/min,X轴单位为标准点的酶活力u/mL。
D.6.2 样品酶活力的计算
从标准曲线上读出样品最终稀释液的酶活力,单位为u/mL。样品的酶活力按照式(D.1)计算:
式中 X6——样品的酶活力,u/g;
X 7——由标准曲线得出的样品最终稀释液的酶活力,u/mL;
V 3——溶解样品用的容量瓶体积,单位为毫升(mL)
n 3——稀释倍数;
m 6——样品的质量,单位为克(g)。
D.6.3 结果的确认
当标准对照的试验值在可接受的范围之内,且标准曲线为平滑下凹的曲线时,样品的试验结果有效,可计算平均值。
标准曲线的相关系数r2应大于0.995。如果r2小于0.995,可删除一个标准点重新计算标准曲线。
D.6.4 结果的表示
样品的测定结果用算术平均值表示.
D.7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不应超过平均值的5%。
[1]Brij®35是适合的市售产品。也可用同等分析效果的产品。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






