对酶催化反应的动力学调节主要集中在对抑制作用的研究上。首先必须搞清楚失活作用与抑制作用的异同,酶抑制与酶失活是两个不同的概念。失活作用是指物理化学或生物因素部分或全部破坏了酶的三维结构,引起酶的变性,导致酶部分或全部丧失活性,失活可以是一时的抑制,也可以是永久的失活。抑制作用是指酶在不变性的条件下,由于活性中心化学性质的改变而引起酶活力的降低或丧失。凡能使酶的活力下降而不引起酶蛋白变性的物质均称为酶的抑制剂。使酶变性失活(称为酶的钝化)的因素(如强酸、强碱等)不属于抑制剂。
根据抑制剂与酶结合的特点,可将抑制作用分为不可逆性抑制和可逆性抑制两类。
1.不可逆性抑制
不可逆抑制剂一般均为非生物来源,它们与酶共价结合破坏了酶与底物结合或酶的催化功能。由于抑制剂与酶共价结合,所以不能用简单的透析、稀释、超滤、凝胶过滤等物理方法除去抑制作用。根据不同抑制剂对酶的选择性不同,又可分为非专一性和专一性不可逆抑制两类。前者是指一种抑制剂可作用于酶分子上的不同基团或作用于几类不同的酶,属于这类的有烷化剂[碘乙酸、2,4-二硝基氟苯(DNFB)等]、酰化剂(酸酐、磺酰氯等);后者是指一种抑制剂通常只能作用于酶蛋白分子中一种氨基酸侧链基团或仅作用于一类酶,如有机汞(对氯汞苯甲酸)可专一性作用于巯基,二异丙基氟磷酸(DFP)和有机磷农药可专一作用于丝氨酸羟基等。
导致酶不可逆抑制的物质主要有以下几大类:①有机磷化合物,如沙林、塔崩、敌敌畏和敌百虫等农药和杀虫剂;②有机汞砷化合物,如路易斯气和砒霜等;③重金属离子,如Ag+、Hg+、Pb+、Cu2+、Fe3+和Fe2+等;④烷化剂,主要包括一些含卤素的化合物,如碘乙酰胺、卤乙酰苯等;⑤氰化物;⑥一些生物自由基。
2.可逆性抑制
酶与可逆性抑制剂的结合是以解离平衡为基础的,属于非共价结合,可以通过透析、超滤等物理方法去除抑制剂后使酶活性恢复。酶的可逆性抑制主要包括竞争性抑制、非竞争性抑制、反竞争性抑制和混合性抑制。
酶催化反应过程中,当有抑制剂存在时,其一般的反应机制如下所示。
其中,I为抑制剂;EI为酶—抑制剂复合物;EIS为酶—抑制剂—底物复合物;Ks、Ki和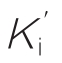 分别为相应中间复合物的解离常数。
分别为相应中间复合物的解离常数。
(1)竞争性抑制 竞争性抑制作用(competitive inhibition)是最简单的抑制模型。抑制剂和底物竞争与酶的同一活性中心结合,从而干扰了酶与底物的结合,使酶的催化活性降低,这种作用称为竞争性抑制作用。其特点为:①竞争性抑制剂往往是酶的底物类似物或反应产物;②抑制剂与酶的结合部位与底物与酶的结合部位相同;③抑制剂浓度越大,抑制作用越大,但增加底物浓度可使抑制程度减小;④其动力学参数Km值增大,vmax值不变。典型的例子是丙二酸对琥珀酸脱氢酶(底物为琥珀酸)的竞争性抑制和磺胺类药物(对氨基苯磺酰胺)对二氢叶酸合成酶(底物为对氨基苯甲酸)的竞争性抑制。竞争性抑制作用可以以图6-13示意。
图6-13 竞争性抑制作用示意图
竞争性抑制作用的速率方程如式(6-8)所示(推导过程略)。
对速率方程的两边取倒数后动力学图如图6-14所示。当固定不用抑制剂浓度时,以1/v对1/[S]作图,各直线与纵坐标轴相交于一点,说明vmax不变,直线与横坐标轴的交点随着抑制剂浓度的增加而向右移动,说明竞争性抑制时Km增大了(1+[I]/Ki)倍。
图6-14 竞争性抑制作用下Lineweaver-Buck曲线图
(2)非竞争性抑制 催化反应过程中,抑制剂既可以与游离酶结合,也可以与ES复合物结合,使酶的催化活性降低,称为非竞争性抑制(noncompetitive inhibition)。其特点为:①底物和抑制剂分别独立地与酶的不同部位相结合;②抑制剂对酶与底物的结合无影响,故底物浓度的改变对抑制程度无影响;③其动力学参数Km不变,vmax降低。(https://www.daowen.com)
非竞争性抑制作用可以以图6-15示意。
图6-15 非竞争性抑制作用示意图
非竞争性抑制作用的速率方程如式(6-9)所示(推导过程略)。
速率方程取双倒数动力学图,如图6-16所示。各直线与横坐标轴相交于一点,说明非竞争性抑制对反应速率vmax影响最大,而不改变Km,[I]越大或Ki越小,抑制因子(1+[I]/Ki)越大,对反应的抑制能力越大。非竞争性抑制在生物体内大多数表现为代谢中间产物反馈调控酶的催化活性。
(3)反竞争性抑制 抑制剂不能与游离酶结合,但可与ES复合物结合并阻止产物生成,使酶的催化活性降低,称为酶的反竞争性抑制(uncompetitive inhibition)。其特点为:①抑制剂与底物可同时与酶的不同部位结合;②必须有底物存在,抑制剂才能对酶产生抑制作用;③其动力学参数Km减小,vmax降低。
图6-16 非竞争性抑制作用下曲线图
反竞争性抑制的特点是,酶必须先与底物结合,然后才与抑制剂结合,即抑制剂与酶—底物复合物的结合是可逆的(图6-17)。
图6-17 反竞争性抑制作用示意图
反竞争性抑制作用的速率方程如式(6-10)所示(推导过程略)。
速率方程取双倒数动力学图,如图6-18所示。随着[I]的变化,横纵坐标轴上的截距均发生了变化,而斜率vmax/Km保持不变;随着[I]的增加,vmax和Km的值均降低了(1+[I]/Ki)倍。反竞争性抑制在单系统中较少见,但是在多元反应系统中是比较常见的动力学模型。
图6-18 反竞争性抑制曲线
(4)混合性抑制 在一般动力学方程中,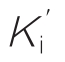 不等于Ki时即E或ES结合I的亲和力以及E或EI结合S的亲和力都不相当时,就是混合性抑制。当
不等于Ki时即E或ES结合I的亲和力以及E或EI结合S的亲和力都不相当时,就是混合性抑制。当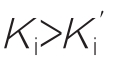 时表现为非竞争与竞争性抑制的混合,而当
时表现为非竞争与竞争性抑制的混合,而当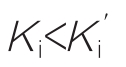 时则表现为非竞争性与反竞争性抑制的混合。
时则表现为非竞争性与反竞争性抑制的混合。
混合型抑制的速率方程如式(6-11)所示。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





