
【实验目的】
【实验试剂与器材】
啤酒酵母;二氧化硅;甲苯(使用前预冷到0 °C以下);去离子水(使用前冷至4 °C左右);冰块、食盐;1N乙酸;7.95%乙醇。
【实验步骤】
1. 提 取
(1)准备一个冰浴,将研钵稳妥放入冰浴中。
(2)称取5 g干啤酒酵母和20 g湿啤酒酵母,称20 mg蜗牛酶及适量(约10 g)二氧化硅,放入研钵中。二氧化硅要先研细。
(3)量取预冷的甲苯30 mL缓慢加入酵母中,边加边研磨成糊状,约需60 min。研磨时用显微镜检查研磨的效果,研至酵母细胞大部分研碎。
(4)缓慢加入预冷的40 mL去离子水,每次加2 mL左右,边加边研磨,至少用30 min。以便将蔗糖酶充分转入水相。
(5)将混合物转入两个离心管中,平衡后,用高速冷离心机离心,4 °C,10 000 r/min,10 min。如果中间白色的脂肪层厚,说明研磨效果良好。用滴管吸出上层有机相。
(6)用滴管小心地取出脂肪层下面的水相,转入另一个清洁的离心管中,4 °C,10 000 r/min,离心10 min。
(7)将清液转入量筒,量出体积,留出1.5 mL测定酶活力及蛋白含量。剩余部分转入清洁离心管中。
(8)用广范pH试纸检查清液pH,用1N乙酸将pH调至5.0,称为“粗级分Ⅰ”。
2. 热处理
(1)预先将恒温水浴调到50 °C,将盛有粗级分Ⅰ的离心管稳妥地放入水浴中,50 °C下保温30 min,在保温过程中不断轻摇离心管。
(2)取出离心管,于冰浴中迅速冷却,用4 °C中以10 000 r/min离心10 min。
(3)将上清液转入量筒,量出体积,留出1.5 mL测定酶活力及蛋白质含量(称为“热级分Ⅱ”)。
3. 乙醇沉淀
将热级分Ⅱ转入小烧杯中,放入冰盐浴(没有水的碎冰撒入少量食盐),逐滴加入等体积预冷至-20 °C的95%乙醇,同时轻轻搅拌,共需30 min,再在冰盐浴中放置10 min,以沉淀完全。于4 °C中以10 000 r/min离心10 min,倾去上清,并滴干,沉淀保存于离心管中,盖上盖子或薄膜封口,然后将其放入冰箱中冷冻保存(称为“醇级分Ⅲ”)。
废弃上清液之前,要用尿糖试纸检查其酶活性(与下一个实验一起做)。
二、离子交换柱层析纯化蔗糖酶
【实验试剂与器材】
(1)DEAE纤维素:DE-23取1.5 g。
(2)0.5 N NaOH 100 mL。
(3)0.5 N HCl 50 mL。
(4)0.02 mol/L pH 7.3 Tris-HCl 缓冲液250 mL。
(5)0.02 mol/L pH7.3(含0.2 mol/L浓度NaCl)的Tris-HCl缓冲液50 mL。
【实验步骤】
1. 离子交换剂的处理
称取1.5 gDEAE纤维素(DE-23)干粉,加入0.5 mol/L NaOH溶液(约50 mL),轻轻搅拌,浸泡至少0.5 h(不超过1 h),用玻璃砂漏斗抽滤,并用去离子水洗至近中性,抽干后,放入小烧杯中,加50 mL 0.5 mol/L HCl,搅匀,浸泡0.5 h,同上,用去离子水洗至近中性,再用0.5 mol/L NaOH重复处理一次,用去离子水洗至近中性后,抽干备用。(因DEAE纤维素昂贵,用后务必回收)。实际操作时,通常纤维素是已浸泡过回收的,按“碱→酸”的顺序洗即可,因为酸洗后较容易用水洗至中性。碱洗时因过滤困难,可以先浮选除去细颗粒,抽干后用0.5 mol/L NaOH-0.5 mol/L NaCl溶液处理,然后水洗至中性。
2. 装柱与平衡
先将层析柱垂直装好,在烧杯内用0.02 mol/L pH 7.3 Tris-HCl 缓冲液洗纤维素几次,用滴管吸取烧杯底部大颗粒的纤维素装柱,然后用此缓冲液洗柱至流出液的电导率与缓冲液相同或接近时即可上样。
3. 上样与洗脱
上样前先准备好梯度洗脱液,本实验采用20 mL 0.02 mol/L pH7.3的Tris-HCl缓冲液和20 mL含0.2 mol/L浓度NaCl的0.02mol/L pH7.3的Tris-HCl缓冲液,进行线性梯度洗脱。取两个相同直径的50 mL小烧杯,一个装20 mL含NaCl的高离子强度溶液,另一个装入20 mL低离子强度溶液,放在磁力搅拌器上,在低离子强度溶液的烧杯内放入一个小搅拌子(在细塑料管内放入一小段铁丝,两端用酒精灯加热封口),将此烧杯置于搅拌器旋转磁铁的上方。将玻璃三通插入两个烧杯中,上端接一段乳胶管,夹上止水夹,用吸耳球小心地将溶液吸入三通(轻轻松一下止水夹),立即夹紧乳胶管,使两烧杯溶液形成连通,注意两个烧杯要放妥善,切勿使一杯高、一杯低。
用5 mL 0.02 mol/L pH7.3的Tris-HCl缓冲液充分溶解醇级分Ⅲ,(注意玻璃搅棒头必须烧圆、搅拌溶解时不可将离心管划伤),若溶液混浊,则用小试管,以4 000 r/min离心除去不溶物。取1.5 mL上清液(即醇级分Ⅲ样品,留待下一个实验测酶活力及蛋白含量),将剩余的3.5 mL清液小心地加到层析柱上,不要扰动柱床,注意要从上样开始使用部分收集器收集,每管2.5~3.0 mL/10 min。上样后用缓冲液洗两次,然后再用约20 mL缓冲液洗去柱中未吸附的蛋白质,至A280降到0.1以下,夹住层析柱出口,将恒流泵入口的细塑料导管放入不含NaCl的低离子强度溶液的小烧杯中,用胶布固定塑料管,接好层析柱,打开磁力搅拌器,放开层析柱出口,开始梯度洗脱,连续收集洗脱液,两个小烧杯中的洗脱液用尽后,为洗脱充分,也可将所配制的剩余30 mL高离子强度洗脱液倒入小烧杯继续洗脱,控制流速2.5~3.0 mL/10 min。
测定每管洗脱液的A280光吸收值和电导率(使用DJS-10电导电极)。
测定不含NaCl的0.02 mol/L pH7.3 Tris-HCl缓冲液和含0.2 mol/L浓度NaCl的0.02 mol/L pH7.3 Tris-HCl缓冲液的电导率,用电导率与NaCl浓度作图,利用此图将每管所测电导率换算成NaCl浓度,并利用此曲线估计出蔗糖酶活性峰洗出时的NaCl浓度。
4. 各管洗脱液酶活力的定性测定
在点滴板上每一孔内,加一滴0.2 mol/L pH4.9的乙酸缓冲液,一滴0.5 mol/L蔗糖和一滴洗脱液,反应5 min,在每一孔内同时插入一小条尿糖试纸,10~20 min后观察试纸颜色的变化。用“+”号的数目,表示颜色的深浅,即各管酶活力的大小。合并活性最高的2~3管,量出总体积,并将其分成10份,分别倒入10个小试管,用保鲜膜封口,冰冻保存,使用时取出一管。此即“柱级分IV”。
注:从上样开始收集,可能有两个活性峰,梯度洗脱开始前的第一个峰是未吸附物,本实验取用梯度洗脱开始后洗下来的活性峰。
在同一张图上画出所有管的酶活力,NaCl浓度(可用电导率代替)和光吸收值A280的曲线和洗脱梯度线。
三、蔗糖酶各级分活性及蛋白质含量的测定
【实验目的】
掌握蔗糖酶活性测定方法,了解各级分酶的纯化情况。
【实验原理】
为了评价酶的纯化步骤和方法,必须测定各级分酶活性和比活。
测定蔗糖酶活性的方法有许多种,如费林试剂法、Nelson’s试剂法、水杨酸试剂法等,本实验先使用费林试剂法,以后测米氏常数Km和最大反应速度Vmax时再用Nelson’s试剂法。
费林试剂法灵敏度较高,但数据波动较大,因为反应后溶液的颜色随时间会有变化,因此加样和测定光吸收值时最好能计时。其原理是在酸性条件下,蔗糖酶催化蔗糖水解,生成一分子葡萄糖和一分子果糖。这些具有还原性的糖与碱性铜试剂混合加热后被氧化,二价铜被还原成棕红色氧化亚铜沉淀,氧化亚铜与磷钼酸作用,生成蓝色溶液,其蓝色深度与还原糖的量成正比,于650 nm测定光吸收值。
【实验试剂与材料】
(1)碱性铜试剂(用毕回收)。
称10 g无水NaCO3,加入100 mL去离子水溶解,另称1.88 g酒石酸,用100 mL去离子水溶解,混合两溶液,再加入1.13 g结晶CuSO4,溶解后定容到250 mL。
(2)磷钼酸试剂(用毕回收)。
在烧杯内加入钼酸17.5 g,钨酸钠2.5 g,10% NaOH 100 mL,去离子水100 mL,混合后煮沸约30 min(小心不要蒸干),驱去钼酸中存在的氨,直到无氨味为止,冷却后加85%磷酸63 mL,混合并稀释到250 mL。
(3)0.25%苯甲酸200 mL,配葡萄糖用,防止时间长溶液长菌,也可以用去离子水代替。
(4)葡萄糖标准溶液。
① 储液:精确称取无水葡萄糖(应在105 °C恒重过)0.1802 g,以0.25%苯甲酸溶液溶解后,定容到100 mL容量瓶中(浓度10 mmol/L)。
② 操作溶液:用移液管取储液10 mL,置于50 mL容量瓶中,以用0.25%苯甲酸或去离子水稀释至刻度(浓度为2 mmol/L)。
(5)0.2 mol/L蔗糖溶液50 mL,分装于小试管中冰冻保存,因蔗糖极易水解,用时取出一管化冻后摇匀。
(6)0.2 mol/L乙酸缓冲液,pH4.9,200 mL。
(7)牛血清清蛋白标准蛋白质溶液(浓度范围:200~500 μg/mL,精确配制50 mL)。
(8)考马斯亮蓝G-250染料试剂,100 mg考马斯亮蓝G-250全溶于50 mL 95%乙醇后,加入120ml 85%磷酸,用去离子水稀释到1L(公用)。
【实验步骤】
1. 各级分蛋白质含量的测定
采用考马斯亮蓝染料法(Bradford法)的微量法测定蛋白质含量,参见“蛋白质含量的测定法”(因Tris会干扰Lowry法的测定)。标准蛋白的取样量为0.1、0.2、0.3、0.4、0.5、0.6、0.8、1.0 mL,用去离子水补足到1.0 mL。
各级分先要仔细寻找和试测出合适的稀释倍数,并详细记录稀释倍数的计算(使用移液管和量筒稀释)。下列稀释倍数仅供参考:
粗级分Ⅰ:10~50倍
热级分Ⅱ:10~50倍
醇级分Ⅲ:10~50倍
柱级分Ⅳ:不稀释
确定了稀释倍数后,每个级分取3个不同体积的样进行测定,然后取平均值,计算出各级分蛋白质浓度。
2. 级分Ⅰ、Ⅱ、Ⅲ蔗糖酶活性测定
用0.02mol/L pH4.9乙酸缓冲液(也可以用pH5~6的去离子水代替)稀释各级分酶液,试测出测酶活合适的稀释倍数:
Ⅰ:1000~10000倍
Ⅱ:1000~10000倍
Ⅲ:1000~10000倍
以上稀释倍数仅供参考。
按“表1”的顺序在试管中加入各试剂,进行测定,为简化操作可取消保鲜膜封口,沸水浴加热改为用90~95 °C水浴加热8~10 min。
3. 柱级分Ⅳ酶活力的测定
(1)酶活力的测定参照“表1”设计一个表格,反应混合物仍为1 mL。
(2)第1管仍为蔗糖对照,9、10管为葡萄糖的空白与标准,与“表1”中的11、12管相同。
(3)2~7管加入柱级分Ⅳ(取样前先试测出合适的稀释倍数),分别为0.02 mL、0.05 mL、0.1 mL、0.2 mL、0.4 mL和0.6mL,然后各加0.2 mL乙酸缓冲液(0.2 mol/L pH4.9),每管用去离子水补充到0.8 mL。
(4)1~7管各加入0.2 mL 0.2 mol/L的蔗糖,每管由加入蔗糖开始计时,室温下准确反应10 min,立即加入1 mL碱性铜试剂中止反应,然后按“表1”中的步骤进行测定。
(5)第8管为0时间对照,与第7管相同,只是在加入0.2 mL蔗糖之前,先加入碱性铜试剂,防止酶解作用。此管只用于观察,不进行计算。
(6)计算柱级分Ⅳ的酶活力:Units / mL原始溶液。
(7)以每分钟生成的还原糖的μmol数为纵坐标,以试管中1 mL反应混合物中的酶浓度(mg蛋白/mL)为横坐标,绘制出反应速度与酶浓度的关系曲线。
级分Ⅰ、Ⅱ、Ⅲ的酶活力测定见表12-3。
表12-3 级分Ⅰ、Ⅱ、Ⅲ的酶活力测定
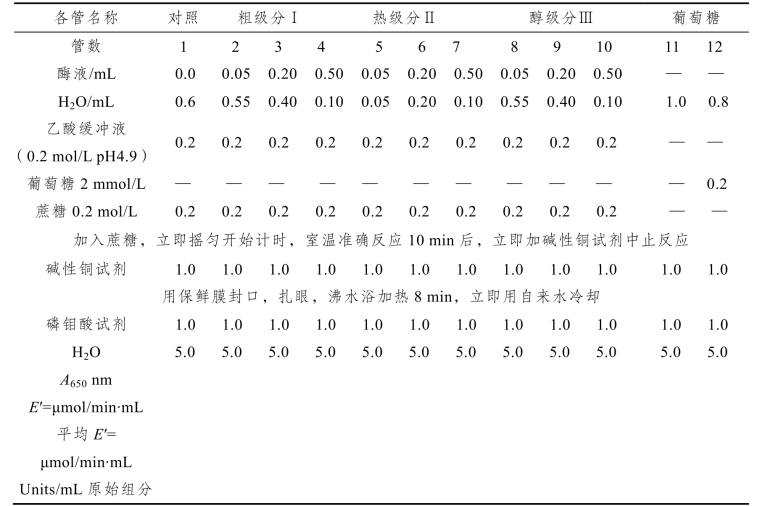
稀释后酶液的活力(按还原糖计算):
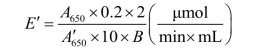
式中:A650—— 第2~10管所测A650
A6′50—— 第12管所测A650
0.2—— 第12管葡萄糖取样量
2—— 标准葡萄糖浓度2 mmol/L = 2 μmol/mL
10—— 反应10 min
B—— 每管加入酶液毫升数
原始酶液的酶活力 E =(平均E′/2)×稀释倍数(Units / mL原始组分)
计算各级分的比活力,纯化倍数及回收率,并将数据列于表12-4。
为了测定和计算下面酶的纯化表中的各项数据,对各个级分都必须取样,每取一次样,对于下一级分来说会损失一部分量,因而要对下一个级分的体积进行校正,以使回收率的计算不致受到不利的影响,见表12-5。
表12-4 酶的纯化表
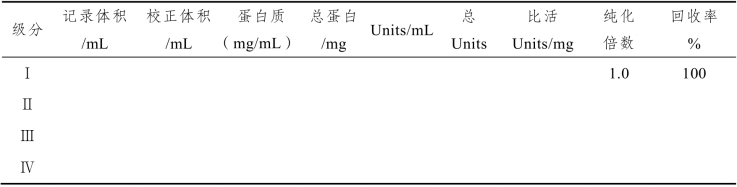
注:一个酶活力单位Units,是在给定的实验条件下,每分钟能催化1μmol蔗糖水解所需的酶量,而水解1 μmol蔗糖则生成2 μmol还原糖,计算时请注意。
表12-5 对假定的各级分记录体积进行校正计算的方法和结果

四、反应时间对产物形成的影响
【实验原理】(www.daowen.com)
酶的动力学性质分析,是酶学研究的重要方面。下面将通过一系列实验,研究pH、温度和不同的抑制剂对蔗糖酶活性的影响,测定蔗糖酶的最适pH、最适温度、蔗糖酶催化反应的活化能,测定米氏常数Km、最大反应速度Vmax和各种抑制剂常数KI,由此掌握酶动力学性质分析的一般实验方法。
本实验是以蔗糖为底物,测定蔗糖酶与底物反应的时间进程曲线,即在酶反应的最适条件下,每间隔一定的时间测定产物的生成量,然后以酶反应时间为横坐标,产物生成量为纵坐标,画出酶反应的时间进程曲线,由该曲线可以看出,曲线的起始部分在某一段时间范围内呈直线,其斜率代表酶反应的初速度。随着反应时间的延长,曲线斜率不断减小,说明反应速度逐渐降低,这可能是因为底物浓度降低和产物浓度增高而使逆反应加强等原因所致,因此测定准确的酶活力,必须在进程曲线的初速度时间范围内进行,测定这一曲线和初速度的时间范围,是酶动力学性质分析中的组成部分和实验基础。
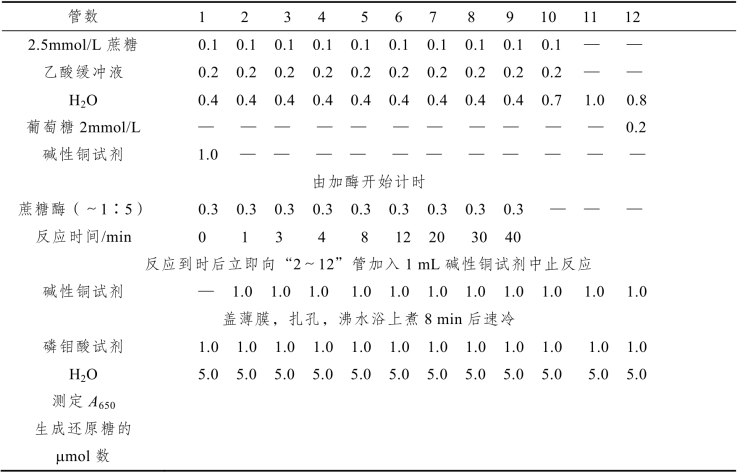
【实验步骤】
(1)准备12支试管,按表12-6进行测定。用反应时间为0的第一管作空白对照,此试管要先加碱性铜试剂后加酶。第10支试管是校正蔗糖的酸水解。用第11管作为对照,测定第12管葡萄糖标准的光吸收值,用以计算第2~9各测定管所生成还原糖的μmol数。
(2)表12-6中底物蔗糖的量为每管0.25 μmol,全部反应后可产生0.5 μmol的还原糖,所有的蔗糖和酶浓度应使底物在20 min内基本反应完。
(3)绘制出生成的还原糖的μmol数(即产物浓度μmol/mL)与反应时间的关系曲线,即反应的时间进程曲线,求出反应的初速度。
表12-6 反应时间对产物浓度的影响
五、pH对蔗糖酶活动性的影响
【实验原理】
酶的生物学特性之一是它对酸碱度的敏感性,这表现在酶的活性和稳定性易受环境pH的影响。
pH对酶的活性的影响极为显著,通常各种酶只在一定的pH范围内才表现出活性,同一种酶在不同的pH下所表现的活性不同,其表现活性最高时的pH称为酶的最适pH。各种酶在特定条件下都有它各自的最适pH。在进行酶学研究时一般都要制作一条pH与酶活性的关系曲线,即保持其他条件恒定,在不同pH条件下测定酶促反应速度,以pH为横坐标,反应速度为纵坐标作图。由此曲线,不仅可以了解反应速度随pH变化的情况,而且可以求得酶的最适PH。
酶溶液pH之所以会影响酶的活性,很可能是因为它改变了酶活性部位有关基团的解离状态,而酶只有处于一种特殊的解离形式时才具有活性,例如:
![]()
酶的活性部位有关基团的解离形式如果发生变化,都将使酶转入“无活性”状态。在最适pH时,酶分子上活性基团的解离状态最适合于酶与底物的作用。此外,缓冲系统的离子性质和离子强度也会对酶的催化反应产生影响。
蔗糖酶有两组离子化活性基团,它们均影响酶水解蔗糖的能力。其解离常数分别是pKa=7和pKa=3。
【实验步骤】
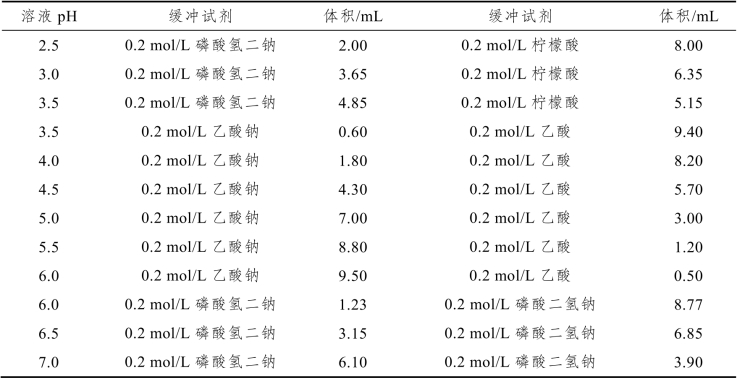
按表12-7配制12种缓冲溶液(公用)。
(1)将两种缓冲试剂混合后总体积均为10 mL,其溶液pH以酸度计测量值为准。
表12-7 缓冲溶液
(2)准备二组各12支试管,第一组12支试管每支都加入0.2 mL上表中相应的缓冲液,然后加入一定量的蔗糖酶,此时的蔗糖酶只能用H2O稀释,酶的稀释倍数和加入量要选择适当,以便在当时的实验条件下能得到0.6~1.0的光吸收值(A650)。另一组12支试管也是每支都加入0.2 mL上表中相应的缓冲液,但不再加酶而加入等量的去离子水,分别作为测定时的空白对照管。所有的试管都用水补足到0.8 mL。
(3)所有的试管按一定时间间隔加入0.2 mL蔗糖(0.2 mol/L)开始反应,反应10 min后分别加入1.0 mL碱性铜试剂,用保鲜膜包住试管口并刺一小孔,在沸水浴中煮8 min,取出速冷,分别加入1.0 mL磷钼酸试剂,反应完毕后加入5.0 mL水,摇匀测定A650。
(4)本实验再准备两支试管,一支用水作空白对照;另一支作葡萄糖标准管。
(5)画出不同pH下蔗糖酶活性(μmol/min)与pH的关系曲线,注意画出pH相同,而离子不同的两点,观察不同离子对酶活性的影响。
六、温度对酶活性的影响和反应活化能的测定
【实验原理】
对温度的敏感性是酶的又一个重要特性。温度对酶的作用具有双重影响,一方面温度升高会加速酶反应速度;另一方面又会加速酶蛋白的变性速度,因此,在较低的温度范围内,酶反应速度随温度升高而增大,但是超过一定温度后,反应速度反而下降。酶反应速度达到最大时的温度称为酶反应的最适温度。如果保持其他反应条件恒定,在一系列不同的温度下测定酶活力,即可得到温度-酶活性曲线,并得到酶反应的最适温度。最适温度不是一个恒定的数值,它与反应条件有关。例如反应时间延长,最适温度将降低。大多数酶在60 °C以上变性失活,个别的酶可以耐100 °C左右的高温。
【实验步骤】
本实验要测定0~100 °C间16个不同温度下蔗糖酶催化和酸催化的反应速度。这16个温度是冰水浴的0 °C,室温(约20 °C),沸水浴的100 °C和13个水浴温度(10 °C、30 °C、40 °C、50 °C、55 °C、60 °C、65 °C、70 °C、75 °C、80 °C、85 °C、90 °C、95 °C)。
每个温度准备两支试管,一支加酶,测酶催化,另一支不加,以乙酸缓冲液作为酸,测酸催化。
(1)确定酶的稀释倍数,试管中加入0.2 mL 0.2 mol/L pH4.9的乙酸缓冲液,0.2 mL稀释的酶,加水至0.8 mL 加入0.2 mL 0.2mol/L的蔗糖开始计时,在室温下反应10 min,仍用费林试剂法进行测定,须得到0.2~0.3 A的吸光度,准备一个水的空白对照管(0.8 mL去离子水加0.2 mL 0.2 mol/L的蔗糖),用于测定所有的样品管。
(2)测定上列各个温度下的反应速度,每次用2支试管,均加入0.2 mL乙酸缓冲液,一支加0.2 mL酶,另一支不加酶,均用水调至0.8 mL,放入水浴温度下使反应物平衡30 s,加入0.2 mol/L蔗糖0.2 mL,准确反应10 min,立即加入1.0 mL碱性铜试剂中止反应,按规定进行操作,测定各管A650值,记录每个水浴的准确温度。
(3)酶催化的各管A650 值均进行酸催化的校正。画出酶催化和酸催化的反应速度对温度的关系曲线。
七、米氏常数Km和最大反应速度Vmax的测定
根据Michaelis-Menten 方程:
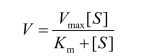
可以得到Lineweaver-Burk双倒数值线方程:
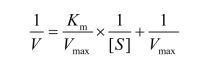
在 1/V纵轴上的截距是1/Vmax,在1/[S]横轴上的截距是-1/Km,如图12-1所示。
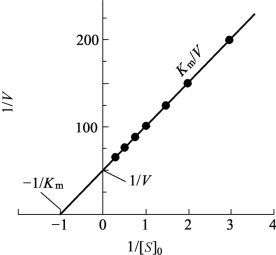
图12-1 Lineweaver-Burk双倒数作图法
测定Km和Vmax,特别是测定Km,是酶学研究的基本内容之一,Km是酶的一个基本的特性常数,它包含着酶与底物结合和解离的性质,特别是同一种酶能够作用于几种不同的底物时,米氏常数Km往往可以反映出酶与各种底物的亲和力强弱,Km值越大,说明酶与底物的亲和力越弱,反之,Km值越小,酶与底物的亲和力越强。
双倒数作图法应用最广泛,其优点是:① 可以精确地测定Km和Vmax;② 根据是否偏离线性很容易看出反应是否违反Michaelis-Menten动力学;③ 可以较容易地分析各种抑制剂的影响。此做法的缺点是实验点不均匀,V小时误差很大。为此,建议采用一种新的Eisenthal直线作图法,即将Michaelis-Menten方程改变为:
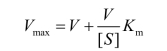
如图12-2所示作图时,在纵轴和横轴上截取每对实验值:V1~[S]1;V2~[S]2;V3~[S]3;连接诸二截点,得多条直线相交于一点,由此点即可得Km和Vmax。
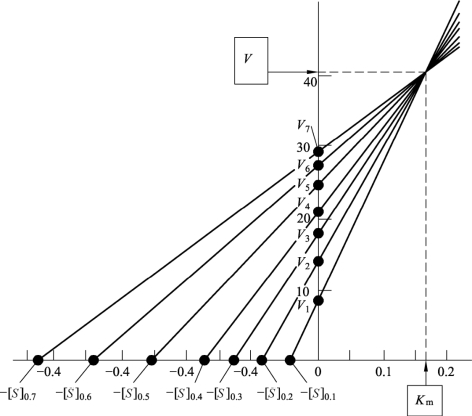
图12-2 Eisenthal直线作图法
此作图法的优点是:① 不用作双倒数计算;② 很容易识别出那些不正确的测定结果。
【实验步骤】
(1)本实验和下一个实验均采用Nelson’s法分析反应产物还原糖,Nelson’s法的试剂配制见本实验最后的“试剂配制方法”。因为使用了剧毒药品,操作必须十分仔细小心。为了掌握Nelson’s法测定的范围,可先作一条标准曲线,按表12-8进行实验操作。
表12-8 Nelson’s法测定葡萄糖的标准曲线
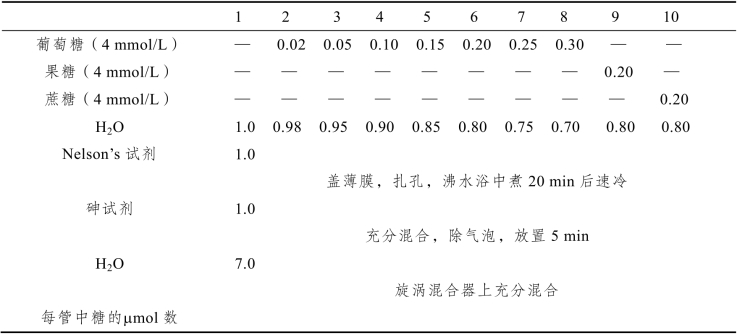
用第1管作空白对照,测定其余各管510 nm的吸光度A510。用A510值对还原糖的μmol数作图。
(2)测定不同底物浓度对催化速度的影响。
为使Km测准,必须先加蔗糖,精确移液,准确计时,每隔30 s或1 min加酶一次,加酶后要摇动一下试管,每支试管都要保证准确反应10 min,然后加1.0 mL Nelson’s试剂,立即用保鲜膜盖住管口,绕上橡皮筋,用针刺一小孔,几根试管用一根橡皮筋套住放入沸水浴,煮20 min后取出放入冷水中速冷。加砷试剂时移液管身不要接触试管壁。最后加7.0 mL H2O以后,要充分摇匀,必要时可用一小块保鲜膜盖住管口,反复倒转试管,混匀。用塑料比色杯测定时,空白对照管溶液必须充分摇匀,彻底除去气泡,测A510值时要检查参比杯内壁上是否有气泡,若有,须倒回原试管,再摇动除去残余气泡。
实验中不允许用嘴吸砷试剂。实验完毕后要注意洗手。
(3)第9、10二管是先加中止反应的Nelson’s试剂,后加酶,以保证加酶后不再产生任何还原糖,用以校正蔗糖试剂本身的水解和酸水解。用第9、10二管的数据画一直线,求出其他各管的校正数据,对所测各管的A510值进行校正,然后计算每管的[S],1/[S],V和1/V。
(4)画出反应速度V与底物浓度[S] 的关系图,(米氏曲线)和1/V~1/[S]双倒数关系图,(不要直接用A510值作图),计算Km和Vmax,并与文献值进行比较,见表12-9。
表12-9 Km和Vmax测定表
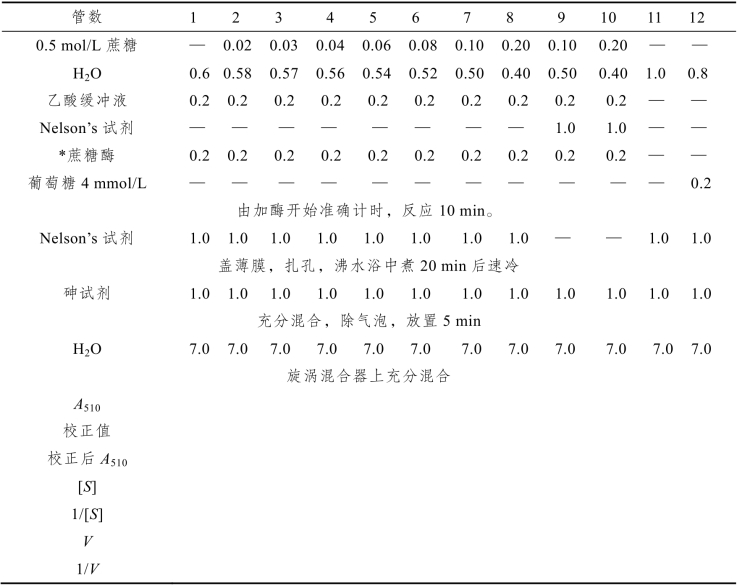
注:*:表4中酶的稀释倍数需仔细试测,使第2管的A510值达到0.2~0.3。
催化反应速度的计算:
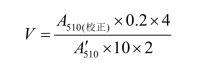
式中:V—— 每毫升反应液,每分钟消耗掉的蔗糖底物的μmol数;
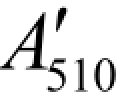 —— 第12管的吸光度值,以11管为参比;
—— 第12管的吸光度值,以11管为参比;
0.2×4—— 4 μmol/mL 葡萄糖取0.2mL;
10—— 反应10 min;
2—— 每μmol蔗糖水解成2μmol还原糖。
【试剂配制】
(1)1 mol/L乙酸:取5.8 mL冰乙酸(17 mol/L)加H2O稀释至100 mL。
(2)0.5 mol/L NaOH:称2g NaOH 溶于100 mL H2O。
(3)0.5 mol/L HCl:取4.2 mL浓HCl(12 mol/L)加入H2O中,稀释到100 mL(注意必须是酸缓慢倒入水中,决不可反之)。
(4)0.02 mol/L pH7.3 Tris-HCl缓冲液:
先配0.1 mol/L Tris Buffer储液:称1.21 g Tris(三羟甲基氨基甲烷MW 121.1)加70 mL H2O溶解,再滴加4 mol/L HCl约21 mL,调pH=7.3,再加H2O至100 mL。取此储液50 mL,加H2O至250 mL。
(5)4 mol/L HCl:取166.7 mL浓HCl(12 mol/L),加H2O至500 mL。
(6)0.02 mol/L pH7.3 Tris-HCl缓冲液(含0.2 mol/L浓度NaCl):
称0.584 g NaCl(MW 58.4)用0.02 mol/L pH7.3的Tris-HCl缓冲溶液溶解,并定容到50 mL。
(7)0.2 mol/L Sucrose:称3.423 g Sucrose(MW 342.3)加H2O溶解,定容到50 mL,分装在10个小试管中冰冻保存。
(8)0.2 mol/L pH4.9乙酸缓冲液。
称2.461 g无水乙酸钠(MW 82.03)溶于150 mL H2O,加40~50 mL 0.2 mol/L乙酸,调pH=4.9,瓶口用薄膜封口,存于4 °C冰箱。
(9)0.5 mol/L Sucrose:称8.558 g Sucrose,加H2O溶解,定容到50 mL,分装于小试管中,冰冻保存。
(10)5 mmol/L Sucrose:取0.5 mol/L Sucrose,稀释100倍。
(11)4 mmol/L Glucose:取40 mL 10 mmol/L Glucose,加H2O 稀释至100 mL,或称0.072 g Glucose(MW 180.2),加H2O溶解定容至100 mL。
(12)4 mmol/L Fructose:称0.072 g Fructose(MW 180.2)加H2O溶解,定容至100 mL。
(13)4 mmol/L Sucrose:称0.137 g Sucrose,加H2O溶解定容到100 mL,现用现配。
(14)0.2 mol/L 柠檬酸C6H8O7·H2O(MW 210.14):称4.203 g溶于100 mL H2O。
(15)0.2 mol/L乙酸:取1.18 mL冰乙酸(17 mol/L)或3.33 mL 36% 乙酸(6 mol/L)加H2O至100 mL。
(16)0.2 mol/L乙酸钠:称1.641 g无水乙酸钠溶于100 mL H2O。
(17)0.2 mol/L磷酸二氢钠NaH2PO4·2H2O(MW 156.01):称3.120 g溶于100 mL H2O。
(18)0.2 mol/L磷酸氢二钠Na2HPO4·12 H2O(MW 358.14):称7.163 g溶于100 mL H2O。
(19)Nelson’s试剂:
① Nelson’s A:称25.0 g无水Na2CO3,25.0 g酒石酸钾钠,20.0 g NaHCO3,200.0 g无水Na2SO4,缓慢溶于H2O,稀释至1 000 mL。
② Nelson’s B:称15.0 g CuSO4·5H2O溶于H2O,加两滴浓H2SO4,用H2O稀释至100 mL,使用时,取50 mL Nelson’s A,加入2 mL Nelson’s B,此溶液易出结晶,可保存在高于20 °C处,若出现结晶,可用温热水浴溶化之。
(20)砷试剂(偶氮砷钼酸盐试剂)(教师配):
称50.0 g钼酸铵,溶于900 mL H2O,搅拌下缓慢加入42 mL浓H2SO4,再称6.0 g砷酸钠或砷酸氢二钠,溶于50 mL H2O,混合这两份溶液,加H2O至1 000 mL,37 °C保温24~48 h,室温暗处存于棕色塑料瓶。
(21)0.1 mol/L磷酸钠缓冲液:称15.6 g NaH2PO4·2H2O溶于800 mL H2O,用10% NaOH调pH=7.0,加H2O至1 000 mL,配G-O试剂用。
【小结】
本章介绍了探索性设计性实验的方法和原则,探索性实验设计的教学过程分为三个阶段:第一阶段由相关任课教师介绍探索性实验设计的一般原则;第二阶段由学生汇报实验设计并分组讨论;第三阶段对修改后可行性较强的实验设计由学校提供条件,学生进行实际操作实施。在这个过程中学生的动手实践能力和创新能力得到了锻炼。
【巩固练习】
(1)设计性实验的原则什么?
(2)设计性实验要注意哪些环节?
(3)如何评判探索性、设计性实验的质量?
【实验小故事】
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






