
实验10-2 双向电泳
(一)样品制备
样品制备是双向电泳中最关键的一步,将直接影响2-DE结果好坏。目前并没有一个通用的样品制备方法,尽管处理方法多种多样,但都遵循几个基本的原则:(1)尽可能地提高样品蛋白的溶解度,抽提最大量的总蛋白,减少蛋白质的损失;(2)减少对蛋白质的人为修饰;(3)破坏蛋白质与其他生物大分子的相互作用,并使蛋白质处于完全变性状态。
【实验材料】
细胞样品。
【实验操作】
(1)胰酶消化贴壁细胞,PBS漂洗3次(1 500 g,5 min),弃上清,再次离心,去尽残液。如要比较细胞膜蛋白组的差别,最好用细胞刮收获细胞。如用10mmol/L Tris/250 mmol/L Sucrose(pH 7.0)代替PBS,可有效降低样品的盐浓度。
(2)加入5倍体积裂解液,混匀(或将1×106细胞悬于60~100μL裂解液中)。
(3)加50 μg/mL RNase及200 μg/mL Dnase,在4 °C放置15 min。
(4)以15 000 r/min在4 °C离心60 min(或以40 000 r/min在4 °C离心30 min)。
(5)收集上清。
(6)测定蛋白浓度(采用BioRad RC/DC protein assay kit)。
(7)分装样品,冻存于-70 °C。
【实验材料】
组织样品。
【实验操作】
(1)将适量粉末状组织转移至匀浆器,加入适量裂解液,进行匀浆。
(2)加50 μg/mL RNase及200 μg/mL DNase,在4 °C放置15 min。
(3)15 000 r/min在4 °C离心60min(或以40 000 r/min在4 °C离心30 min)。
(4)收集上清,测定蛋白浓度。
(5)分装样品,冻存于-70 °C。
注意事项:
(1)8 mmol/L PMSF必须在添加还原剂之前用,否则PMSF会失去活性。
(2)40 mmol/L浓度以下的Tris可使有些蛋白酶在高pH下失活。
(3)细胞清洗:大多用PBS,若PBS残留于细胞表面会造成胶上出现水平条纹,则可利用10 mmol/L Tris,250 mmol/L sucrose pH 7.0来解决。
(二)样品上样
【实验操作】
(1)从冰箱中取出IPG胶条,室温放置10 min。
(2)沿水化盘槽的边缘从左向右线性加入样品,槽两端各1 cm左右不加样,中间的样品液一定要连贯。注意:不要产生气泡,否则会影响胶条中蛋白质的分布。
(3)用镊子轻轻撕去IPG胶条上的保护层。注意:碱性端较脆弱,应小心操作。
(4)将IPG胶条胶面朝下轻轻置于水化盘中样品溶液上。注意:不要将样品溶液弄到胶条背面,因为这些溶液不会被胶条吸收;还使胶条下面的溶液产生气泡。若产生了气泡,用镊子轻轻地提起胶条的一端,上下移动胶条,直到气泡被赶走。
(5)放置30~45 min大部分样品被胶条吸收,沿着胶条缓慢加入矿物油,每根胶条约3 mL(17 cm IPG),防止胶条水化过程中液体蒸发。
(6)置等电聚焦仪于-20 °C中水化11~15 h。
(三)第一向等电聚焦
【实验操作】
(1)将纸电极置于聚焦盘的正负极上,加ddH2O 5~8 μL润湿。
(2)取出水化好的胶条,提起一端将矿物油沥干,胶面朝下,将其置于刚好润湿的滤纸片上杂交以去除表面上的不溶物。
(3)将IPG胶条胶面朝下置于聚焦盘中,胶条的正极(标有+)对应于聚焦盘的正极,确保胶条与电极紧密接触。
(4)在每根胶条上覆盖2~3 mL矿物油。
(5)对好正、负极,盖上盖子。设置等电聚焦程序。
(6)聚焦结束的胶条,立即进行平衡、第二向SDS-PAGE电泳。或将胶条置于样品水化盘中,-20 °C冰箱保存,电泳前取出胶条,室温放置10 min,使其溶解。
(四)SDS-PAGE电泳
【实验操作】
(1)配制12%的丙烯酰胺凝胶。
(2)待凝胶凝固后,倒去分离胶表面的MilliQ水、乙醇或水饱和正丁醇,用MilliQ水冲洗。
(3)配制胶条平衡缓冲液Ⅰ。
(4)在桌上先放置干的厚滤纸,聚焦好的胶条胶面朝上放在干的厚滤纸上。将另一份厚滤纸用MilliQ水浸湿,挤去多余水分,然后直接置于胶条上,轻轻吸干胶条上的矿物油及多余样品,这样可以减少凝胶染色时出现的纵条纹。
(5)将胶条转移至样品水化盘中,加入6 mL(17 cm IPG)平衡缓冲液Ⅰ,在水平摇床上缓慢摇晃15 min。
(6)配制胶条平衡缓冲液Ⅱ。
(7)第一次平衡结束后,取出胶条将之竖在滤纸上沥去多余的液体,放入平衡缓冲液Ⅱ中,继续在水平摇床上缓慢摇晃15 min。
(8)用滤纸吸去SDS-PAGE胶上方玻璃板间多余的液体,将二向凝胶放在桌面上,凝胶的顶部面对自己。
(9)将琼脂糖封胶液加热溶解。
(10)在100 mL量筒中加入TGS电泳缓冲液。
(11)第二次平衡结束后,取出胶条,用滤纸吸去多余的平衡液(将胶条竖在滤纸上,以免损失蛋白或损坏凝胶表面)。(www.daowen.com)
(12)用镊子夹住胶条的一端使胶面完全浸没在1×电泳缓冲液中漂洗数次。
(13)将胶条背面朝向玻璃板,轻轻放在长玻板上,加入低熔点琼脂糖封胶液。
(14)用适当厚度的胶片,轻轻地将胶条向下推,使之与聚丙烯酰胺凝胶胶面完全接触。
注意:不要在胶条下方产生气泡,应推动凝胶背面的支撑膜,不要碰到胶面。
(15)放置5 min,使低熔点琼脂糖封胶液凝固。
(16)打开二向电泳制冷仪,调温度为15 °C。
(17)将凝胶转移至电泳槽中,加入电泳缓冲液,接通电源,起始时用的低电流(5~10 mA/gel/17 cm),待样品在完全走出IPG胶条,浓缩成一条线后,再加大电流(20~30 mA/gel/17 cm)待溴酚蓝指示剂达到底部边缘时即可停止电泳。
(18)电泳结束后,轻轻撬开两层玻璃,取出凝胶,并切角以作记号(戴手套,防止污染胶面)。
(19)进行染色。
(五)SDS-PAGE胶染色
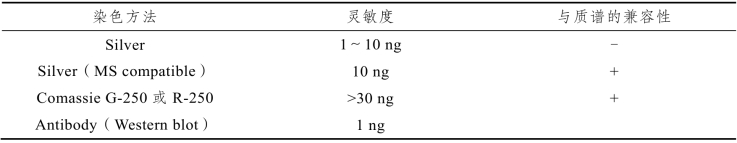
表10-1 各种蛋白染色方法的灵敏度比较
1. 考马斯亮蓝染色
【实验材料】
(1)CBB染色液。
(2)0.5%考马斯亮蓝G250或R250。
(3)40%甲醇。
(4)10%乙酸。
(5)脱色液:30%甲醇+10%乙酸。
【实验步骤】
(1)在摇床上染色30 min。
(2)脱色至蛋白点或条带清晰可见。
(3)ddH2O洗3~5次。
2. 胶体考马氏亮蓝染色
【实验步骤】
(1)固定:甲醇/醋酸/H2O(45∶1∶54)至少20 min。
(2)染色12~18 h。染色液:17%(W/V)硫酸铵;34%甲醇;0.5%醋酸;0.1%(W/V)Coomassie G250。
(3)脱色:用H2O脱色至蛋白点和背景清晰。
(六)双向电泳蛋白点的切取和保存
【实验步骤】
(1)用PDQuest软件或肉眼比对,找出感兴趣的蛋白点,并做好标记和记录。
(2)用MilliQ水冲洗胶2次。
(3)用色谱纯甲醇和MilliQ水冲洗Ep管。
(4) 将枪头(200 μL)下端剪去,使其内径略小于蛋白斑点的直径,用色谱纯甲醇和MilliQ水冲洗枪头。
(5)对准斑点中央小心将蛋白切割下来,放入Ep管,MilliQ水漂洗2次,如胶块太大,将其切成1 mm×1 mm的胶片。
(6)将切好的点做好标记和记录,置-80 °C保存或冻干后置-20 °C存放。
【注意事项】
(1)尽量避免皮肤和头发的角蛋白的污染,在操作过程中应戴一次性的PE手套(不用乳胶手套)和帽子。
(2)不要将胶长期存放于乙酸溶液中。
(3)Ep管及染胶的容器必须用甲醇和水充分清洗,尤其应与进行Western blotting的容器分开,以避免casein或BSA的污染。
(七)考染SDS-PAGE条带酶解,提肽
【实验步骤】
(1)切胶前用ddH2O洗胶2~3次,以除去残留的乙酸和乙醇。
(2)用塑料切胶片将胶切成1 mm3大小的胶粒,盛于0.6 mL EP管中。
(3)脱色:加入100 μL(对于小胶的一条带)50%ACN/50%50mmol/L NH4HCO3(即1/2的ACN与1/2的100 mmol/L NH4HCO3的混合液),漩涡混合仪上混旋10~30 min(根据脱色情况,可延长时间至30~45 min),去掉上清,重复1~2次,直到完全脱色(实在脱不掉,有时也不影响下游的酶解和质谱)。
(4)干胶:加100 μL ACN混匀,室温下放置5~10 min,可见胶粒变白,吸去ACN;重复1~2次,于37 °C置10~20 min,残留的ACN挥发尽。
(5)加酶:胰酶用0.1%的乙酸配成100 ng/μL的储存液。使用时,用40 mmol/L NH4HCO3 /10%ACN稀释成12.5 ng/μL的使用液。每管加12.5 ng/μL的胰酶10~15 μL(根据情况定量,酶液没过胶粒即可),将胶粒没过。4°C放15min,取出,吸去多余的胰酶,加入15 μL的40 mmol/L NH4HCO3/10%ACN(也可用ddH2O)覆盖,防止蒸发。
(6)酶解:37 °C,酶解过夜(一般16 h,3~6 h即可)。
(7) 提肽:将酶液转移到新的0.6 mL EP管中,胶粒中加入50~80 μL 50%ACN/5%TFA,超声(放冰袋)10~15 min,离心,上清合并;再加入20~50 μL 50%ACN/5%TFA,重复1~2次,上清合并。
(8)封上parafilm 膜,扎孔,-80 °C冷冻上清,进行冻干。
(9)冻干后的样品如不立即用,于-80°C保存。
(10)若做MALDI-MS,溶于1~3 μL样品准备液(50%ACN/0.1%甲酸),做靶鉴定;若做LC-MS,溶于15~25 μL 样品准备液(50%ACN),质谱鉴定
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







