
【实验目的】
(1)掌握琼脂糖凝胶电泳检测DNA的原理和方法。
(2)熟悉琼脂糖凝胶电泳仪器的使用。
(3)了解实验不同结果原因及分析。
【实验原理】
琼脂糖凝胶电泳是一个电场作用。它首先利用琼脂糖的分子筛效应;此外,在弱碱性条件下,DNA分子带负电荷,从负极向正极移动。根据DNA分子大小、结构及所带电荷的不同,它们以不同的速率通过介质运动而相互分离。借助溴化乙锭(EB)能与双链DNA结合的作用,利用EB染色,并通过紫外线激发即可观察被分离DNA片段的位置。琼脂糖凝胶电泳技术(Agarose gel electrophoresis)是分离、鉴定和提纯DNA片断的有效方法。凝胶分辨率决定于使用材料的浓度,并由此决定凝胶的孔径。琼脂糖凝胶可分辨0.1~6.0 kb的双链DNA片段。
【实验试剂与器材】
1. 实验试剂
(1)琼脂糖。
(2)10×TAE电泳缓冲液。
(3)上样缓冲溶液(0.25%溴酚蓝,30%甘油)。
(4)三羟甲基氨基甲烷(Tris)、硼酸、乙二胺四乙酸(EDTA)。
(5)核酸染料。
(6)DNA marker。
2. 实验器材
琼脂糖凝胶电泳系统,凝胶成像系统。
【实验步骤】
(1)取琼脂糖0.9 g,加入100 mL 1×TAE电泳缓冲液于250 mL烧瓶中,100 °C加热溶解。(www.daowen.com)
(2)平衡凝胶槽,放好两侧挡板,调节好梳子与底板的距离(一般高出底板0.5~1 mm)。
(3)铺板:在溶解好的凝胶中加入终浓度为0.5 μg/mL的溴化乙锭水溶液,轻轻混匀,待冷至50 °C左右倒入凝胶槽,胶的厚度一般为5~8 mm。
(4)待胶彻底凝固后,去掉两侧挡板,将凝胶放入盛有电泳液的槽中(加样孔朝向负极端,DNA由负极向正极移动),使液面高出凝胶2~3 mm,小心拔出梳子。
(5)DNA样品与载体缓冲液5∶1混合并加入凹孔中(样品不可溢出)。
(6)打开电源,调节所需电压,电压与凝胶的长度有关,一般使用电压不超过5 V/cm。
(7)据指示染料移动的位置,确定电泳是否终止(溴酚蓝的涌动距离在5sRNA和0.3 kb DNA带之间)。
(8)电泳完毕关闭电源。将凝胶放紫外灯下观察并拍照,电泳检测分析结果如图9-2所示。
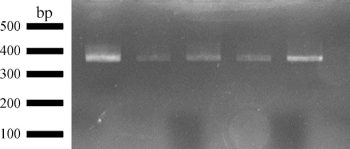
图9-2 琼脂糖凝胶电泳检测分析结果
【注意事项】
(1)在使用Golden View等核酸荧光染料时,操作时应戴手套,尽量减少台面污染。
(2)一般来说低浓度、低电压下,分离效果较好。线性DNA分子的电泳迁移率与所用的电压呈正比。但是,在电场强度增加时,较大的DNA片段迁移率的增加相对较小。因此随着电压的增高,电泳分辨率反而下降,为了获得电泳分离DNA片段的最大分辨率,电场强度不宜高于5 V/cm。
(3)温度对于DNA在琼脂糖凝胶中的电泳行为没有显著的影响。通常在室温下进行电泳,只有当凝胶浓度低于0.5%时,为增加凝胶硬度,可在4 °C,进行电泳。
【讨论与思考】
(1)何为电泳?影响泳动速率的因素有哪些?
(2)简述核酸构型与琼脂糖凝胶电泳分离的关系。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







