【实验目的】
(1)掌握各种核酸含量测定的基本原理。
(2)熟悉各种核酸含量测定的具体操作方法及分光光度计的工作原理及操作。
(3)了解其他核酸含量测定方法及核酸含量测定方法在科学研究中的作用。
一、紫外吸收法测定核酸含量
【实验原理】
核苷、核苷酸、核酸的组成成分中都有嘌呤、嘧啶碱基,这些碱基都具有共轭双键,在紫外光区的250~280 nm处有强烈的光吸收作用,最大吸收值在260 nm左右。常利用核酸的紫外吸收性进行核酸的定量测定。核酸的摩尔消光系数ε(P)表示为每升溶液中含有1摩尔原子磷的光吸收值。RNA的ε(P)260 nm(pH 7.0)为7 700~7 800,RNA的含磷量约9.5%,因此每毫升溶液含1μg RNA的光吸收值相当于0.022~0.024。小牛胸腺DNA钠盐的ε(P) 260 nm(pH 7.0)为6 600,含磷量为9.2%,因此每毫升溶液含 1μg DNA钠盐的光吸收值相当于0.020。测出260 nm处的光吸收值,可计算出核酸的含量。当核酸变性降解时,其紫外吸收强度显著增加,称为增色效应。
通常蛋白质的吸收高峰在280 nm波长处,在260 nm处的吸收值仅为核酸的1/10或更低,因此对于含有微量蛋白质的核酸样品,测定误差较小。若待测的核酸制品中混有大量的具有紫外吸收的杂质,则测定误差较大,应设法除去。不纯的样品不能用紫外吸收值作定量测定。
根据A260/A280的比值可判断样品的纯度。纯RNA的A260/A280≥2.0;DNA的A260/A280≥1.8。当样品中蛋白质含量较高时,则比值下降。RNA和DNA的比值分别低于2.0和1.8时,表示此样品不纯。pH对核酸紫外吸收性有影响,所以测定时要固定溶液的pH。
【实验试剂与器材】
1. 试 剂
待测的DNA(RNA)溶液、蒸馏水。
2. 器 材
分光光度计、试管、试管架、烧杯、擦镜纸。
【实验步骤】
(1)样品做适当倍数的稀释(保证吸光度值读数在0.2~0.8),将稀释液置于厚度为1 cm的石英比色杯,在260 nm波长处测定A值,以蒸馏水作空白。
(2)DNA(RNA)样品纯度的检测:分别在260 nm和280 nm波长处测定样品液的吸光度,求出样品液的A260/A280比值,判断样品的纯度。
(3)计算:试液中DNA/RNA总含量按下式计算:
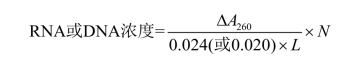
式中:ΔA260—— 稀释液在260 nm波长处A值读数;
N—— 稀释倍数;
0.024(或0.020)—— 1 mg/mL RNA(或DNA)溶液测定的A260值相当于0.024。
【注意事项】
(1)DNA样品作适当稀释时,稀释倍数应从小到大。
(2)紫外分光光度计所使用的比色皿必须保证其光面洁净,若有液体可用吸水纸吸干,不可以擦,其他可用擦镜纸擦干净,以免影响实验结果。
【讨论与思考】
(1)测定样品的核酸含量的方法有哪些,有何优点及缺点?
(2)利用分光光度计检测核酸含量时必须用石英比色皿,为什么?
二、定磷法测定核酸含量
【实验原理】
核酸分子结构中含有一定比例的磷(RNA含磷量约为8.5%~9.0%,DNA含磷量约为9.2%),测定其含磷量即可求出核酸的量。核酸分子中的有机磷经强酸消化后形成无机磷,在酸性条件下,无机磷与钼酸铵结合形成黄色磷钼酸铵沉淀,其反应为:
![]()
在还原剂存在的情况下,黄色物质变成蓝黑色,称为钼蓝。在一定浓度范围内,蓝色的深浅与磷含量成正比,可用比色法测定。若样品中尚含有无机磷,需做对照测定,消除无机磷的影响,以提高准确性。定磷法既可以测定DNA的含量又可以测定RNA的含量,若DNA中混有RNA或RNA中混有DNA,都会影响结果的准确性。
【实验试剂与器材】
1. 试 剂
(1)标准磷溶液:将磷酸二氢钾于110 °C烘至恒重,准确称取0.8775 g溶于少量蒸馏水中,转移至500 mL容量瓶中,加入5 mL硫酸溶液(5 mol/L)及氯仿数滴,用蒸馏水稀释至刻度。此溶液每1mL含磷400 μg,临用时准确稀释20倍(20 μg/mL)。
(2)定磷试剂。
① 17%硫酸:17 mL浓硫酸(相对密度l.84)缓缓加入到83 mL水中。
② 2.5%钼酸铵溶液:2.5 g钼酸铵溶于100 mL水。
③ 10%抗坏血酸溶液:10 g抗坏血酸溶于100 mL水,并储存于棕色瓶中,溶液呈淡黄色尚可使用,呈深黄甚至棕色即失效。
临用时将上述三种溶液与水按如下比例混合:溶液①∶溶液②∶溶液③∶水=1 ∶1 ∶1 ∶2(V∶V)
(3)5%氨水、27%硫酸。
2. 器 材
恒温水浴、721分光光度计。
【操作步骤】
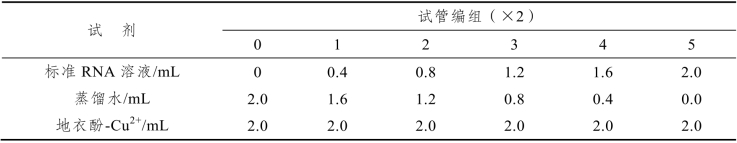
(1)取7支干燥试管编号,按表8-1所示加入试剂,制定定磷标准曲线。
表8-1
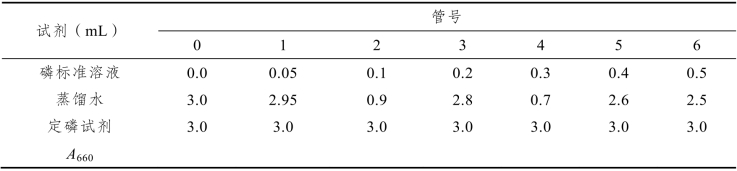
加毕摇匀,在45 °C水浴中保温10 min,冷却,以0号管调零点,于660 nm处测吸光度以磷含量为横坐标,吸光度为纵坐标作图。
(2)总磷的测定:称粗核酸0.1g,用少量水溶解(若不溶,可滴加5%氨水至pH 7.0),待全部溶解后,移至50 mL容量瓶中,加水至刻度(此溶液含样品2 mg/mL),即配成核酸溶液。吸取上述核酸溶液1.0 mL,置大试管中,加入2.5 mL 27%硫酸及一粒玻璃珠,于通风橱内直火加热至溶液透明(切勿烧干),表示消化完成。冷却后取下,将消化液移入100 mL容量瓶中,以少量蒸馏水洗涤试管2次,洗涤液一并倒入容量瓶,再加蒸馏水至刻度,混匀后吸取3 mL溶液置试管中,加3 mL定磷试剂,45 °C水浴保温10 min后取出,测波长为660 nm时的OD值(A660)。
(3)无机磷的测定:吸取核酸溶液1 mL,置于100 mL容量瓶中,加水至刻度,混匀后吸取3.0 mL置试管中,加定磷试剂3.0 mL,45 °C水浴中保温10 min后取出,测A660。
(4)结果处理:
![]()
从标准曲线上查出有机磷微克数(X),按下式计算样品中核酸百分含量:

【注意事项】
(1)要求试剂及所有器皿清洁,不含磷。
(2)每管加样和测定均要求平行操作。
(3)消化溶液定容后务必上下颠倒混匀后再取样。
(4)各种试剂必须用移液管按顺序准确量取,移液管口用吸水纸擦净,溶液尽量加到试管下部,标准溶液要求用差量法。
(5)测定吸光度时,用一个比色杯装去离子水,调节分光光度计零点,另一个比色杯若按照从低浓度到高浓度的顺序测定,则比色杯不需要润洗。切忌用力甩比色杯,以免将蓝色溶液洒在仪器和地面上。
【讨论与思考】
(1)简述实验所用的水质、试剂质量、定磷试剂的酸度对测定结果的影响。
(2)该方法的干扰物质有哪些?
三、二苯胺法测定核酸的定量
【实验原理】(www.daowen.com)
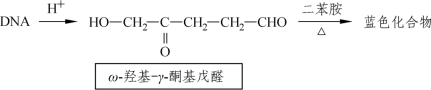
脱氧核糖核酸中的2-脱氧核糖在酸性环境中变成ω-羟基-γ-酮基戊醛,与二苯胺试剂一起加热产生蓝色化合物,该化合物在595 nm波长处有最大紫外吸收峰。该方法适用于含量为40~400 μg的DNA样品,此时吸光度与DNA的浓度成正比。在反应液中加入少量乙醛,可以提高反应灵敏度。除DNA外,脱氧木糖、阿拉伯糖也有同样反应。其他多数糖类,包括核糖在内,一般无此反应。
【实验材料】
1. 试 剂
(1)DNA标准溶液(须经定磷确定其纯度):用5 mmol/L NaOH溶解小牛胸腺DNA钠盐配成200 μg/mL的溶液。
(2)样品待测液:准确称取DNA干燥制品以5 mmol/L NaOH溶液配成50~200 μg/mL的溶液。在测定RNA制品中的DNA含量时,要求RNA制品的每毫升待测液中至少含有20 μg DNA,才能进行测定。
(3)二苯胺试剂。A液:称取1 g重结晶二苯胺,溶于100 mL分析纯的冰乙酸中,再加入10 mL过氯酸(60%以上),混匀储于棕色瓶中待用。B液:配制1.6%的乙醛液,临用前配制。临用时将20 mL A液与0.1 mL B液混合即得二苯胺试剂。
2. 器 材
分析天平、恒温水浴锅、分光光度计、移液管、试管等。
【实验步骤】
1. 采用紫外吸收法检测各组DNA样品的纯度及含量
对DNA样品作适当稀释后,分别在260 nm和280 nm波长处测定样品液的吸光度,求出样品液的A260/A280比值以判断各组DNA样品的纯度,以及根据1OD值≈50 μg/mL(dsDNA),计算出DNA样品的浓度,以判断是否符合二苯胺法对所检测的DNA样品的浓度要求(应为40~400 μg/mL)。
2. 检测各组DNA样品含量(二苯胺法)
(1)标准曲线绘制:取干燥试管7支,按表8-2中0~6号管操作,以DNA含量(μg)为横坐标,吸光度值(A595)为纵坐标,绘制标准曲线,得线性方程。
表8-2
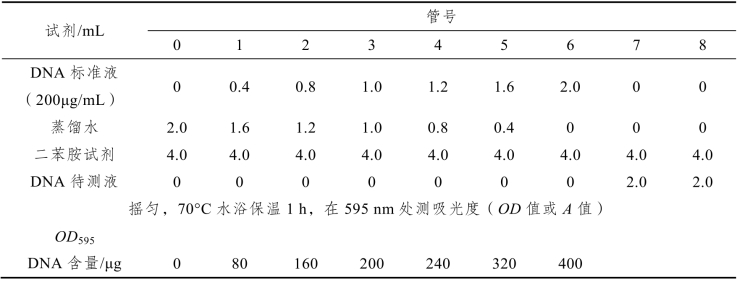
(2)样液测定:取2支试管按表8-2中7、8号管操作。测定DNA样品管的OD值,代入方程计算DNA含量。
DNA%=样液中测得的DNA量(μg)×100 / 样液中的所含样品量(μg)
【注意事项】
(1)因为二苯胺法测定DNA含量时对样品中DNA浓度有要求,所以在检测之前要对样品进行适当稀释。
(2)二苯胺试剂加热时,应在通风橱内操作。
【讨论与思考】
(1)二苯胺法测定DNA含量时,反应液中会加入少量乙醛,其作用是什么?
(2)DNA含量测定的方法有哪些?各有何优缺点?
(3)区分RNA和DNA的方法有哪些?
四、核酸的定量测定-地衣酚(苔黑酚)法
【实验原理】
RNA含量测定,除可用紫外吸收法及定磷法外,常用地衣酚法测定。其反应原理是:当RNA与浓盐酸共热时,即发生降解,形成的核糖继而转变成糠醛,后者与3,5-二羟基甲苯(地衣酚orcinol)反应,在Fe3+或Cu2+催化下,生成鲜绿色复合物。反应产物在670 nm处有最大吸收。RNA浓度在20~250 μg/mL范围内,光吸收与RNA浓度成正比。地衣酚法特异性差,凡戊糖均有此反应,DNA和其他杂质也能与地衣酚反应产生类似颜色。因此,测定PNA时可先测得DNA含量再计算RNA含量。
【实验材料】
1. 实验试剂
(1)RNA标准溶液(须经定磷确定其纯度):取酵母RNA配成100 μg /mL的溶液。
(2)样品待测液:配成每毫升溶液含RNA干燥制品50~100 μg。
(3)地衣酚试剂:先配0.1%三氯化铁的浓盐酸(分析纯)溶液,实验前用此溶液作为溶剂配成0.1%地衣酚溶液。
2. 实验器材
分析天平、沸水浴锅、试管、吸量管、分光光度计等。
【实验步骤】
1. 标准曲线的制作
取12支干净烘干试管,按表8-3编号及加入试剂,平等分作两份,加毕置沸水浴加热25 min,取出冷却,以0号管作对照,于670 nm波长处测定光吸收值。取两管平均值,以RNA浓度为横坐标,光吸收为纵坐标作图,绘制标准曲线。
表8-3
2. 样品的测定
取两支试管,各加入2.0 mL样品液,再加2.0 mL地衣酚-Cu2+试剂。如前述进行测定。
3. RNA含量的计算
根据测得的光吸收值,从标准曲线上查出相当该光吸收的RNA含量,按下式计算出制品中RNA的百分含量:
RNA % = 待测样液中测得的RNA量(μg)×100/待测样液中的所含样品量(μg)
【注意事项】
(1)样品中蛋白质含量较高时,应先用5%三氯乙酸溶液沉淀蛋白质后再测定。
(2)本法特异性较差,凡属戊糖均有反应。微量DNA无影响,较多DNA存在时,亦有干扰作用。如在试剂中加入适量CuCl2·2H2O可减少DNA的干扰,甚至某些己糖在持续加热后生成的羟甲基糖醛也能与地衣酚反应,产生显色复合物。此外,利用RNA和DNA显色复合物的最大光吸收不同,且在不同时间显示最大色度加以区分。反应2 min后,DNA在600 nm呈现最大光吸收,而RNA则在反应15 min后,在670 nm下呈现最大光吸收。
【讨论与思考】
(1)定磷法操作中有哪些关键环节?
(2)利用二苯胺法测定DNA含量时,若DNA样品中混有DNA或蛋白质、糖类时,是否会有干扰?
(3)利用地衣酚(苔黑酚)法测定RNA的含量,灵敏度较高,但特异性较差,有哪些干扰因素?如何排除干扰?
【小结】
核酸包括DNA、RNA两种分子,在细胞中都是以与蛋白质结合的状态存在。核酸分离纯化最基本的原则是保持核酸分子一级结构的完整性和纯度,同时防止核酸的生物降解。因此尽量简化操作步骤,缩短提取过程,以减少各种不利因素,例如机械剪切力、高温等物理因素,有机溶剂和过高浓度金属离子、强酸强碱等化学因素,以及其他生物大分子如蛋白质、多糖和脂类分子的污染。总之,核酸提取的主要步骤,无外乎破碎细胞,去除与核酸结合的蛋白质以及多糖、脂类等生物大分子,去除其他不需要的核酸分子,沉淀核酸,去除盐类,有机溶剂等杂质,纯化核酸等。核酸提取的方案,应根据具体生物材料和待提取的核酸分子的特点而定,对于某特定细胞器中富集的核酸分子,事先提取该细胞器,然后提取目的核酸分子的方案,可获得完整性和纯度两方面质量均高的核酸分子。
核酸因分子组成中的碱基含有共轭双键,在260 nm处有最高的吸收峰,因此常利用核酸的紫外吸收性进行核酸的定量测定。该方法操作简便,蛋白质和核苷酸对其有较大的干扰。定磷法,在核酸消化的基础上,测定其无机磷量,由此计算出核酸含量,该方法反应灵敏,因该方法同时适合DNA和RNA的检测,若DNA中混有RNA或RNA中混有DNA,都会影响结果的准确性。二苯胺法利用DNA中的脱氧核糖在酸性溶液中转化为ω-羟基-γ-酮基戊醛,它可与二苯胺试剂在加热的条件下产生蓝色化合物,该化合物在595 nm波长处有最大紫外吸收峰。该方法对所检测的DNA浓度有要求,即为40~400 μg/mL的DNA样品,故检测之前需对待检测DNA样品的含量进行初步判定。地衣酚法只适用于测定RNA的含量,RNA与浓盐酸共热,降解形成的核糖转变为糠醛,利用地衣酚反应来测定,特异性差,戊糖均有此反应。
【巩固练习】
(1)简述DNA分子的结构特征。
(2)什么是增设效应?
(3)什么是DNA的变性和复性?
(4)DNA的呈色反应有哪些?
(5)核酸分子杂交的概率及种类有哪些?
【实验小故事】
酵母丙氨酸转移核糖核酸含有11种核苷酸(4种常见的和7种修饰的核苷酸),具有完全的生物活性,既能接受丙氨酸,又能将所携带的丙氨酸渗入到蛋白质的合成体系中。由于tRNA在蛋白质生物合成中有着重要的作用,而用合成方法改变tRNA的结构以观察对其功能的影响,又是研究tRNA结构与功能的最直接手段,所以酵母丙氨酸tRNA人工合成的成功,在科学上特别在生命起源的研究上有重大意义。
从1968年起,我国科学工作者开始人工合成酵母丙氨酸转移核糖核酸的研究。这种核糖核酸由76个核苷酸组成,其中除了4种常见的核苷酸外,还有7种稀有的核苷酸。经过千百次的探寻和摸索,中国科学院上海生化研究所研究员王德宝等终于自行制备出了11种核苷酸、近10种核糖核酸工具酶和有关的化学试剂等,并采取有机化学和酶促合成的方法,先合成了几十个长度为2~8核苷酸的寡核苷酸,然后用T4RNA连接酶连接成6个大片段(长度为9~19核苷酸),再接成两个半分子(长度分别为35和41核苷酸)。1981年11月20日经氢键配对,T4RNA连接酶连接,在世界上首次人工合成了76核苷酸的整分子酵母丙氨酸tRNA。以后又进行了五次重复合成试验,均获得了成功。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






