
【实验目的】
(2)熟悉蛋白质SDS-聚丙烯酰胺凝胶电泳的操作方法。
(3)了解SDS-聚丙烯酰胺凝胶电泳的应用范围。

SDS-PAGE
【实验原理】
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)是由丙烯酰胺和交联剂N,N′-甲叉双丙烯酰胺在催化剂(过硫酸铵)和增速剂(四甲基乙二胺)的作用下聚合而成的。聚丙烯酰胺凝胶为网状结构,具有分子筛效应,因此可以达到分离样品中不同分子量蛋白质的目的。
SDS是一种阴离子去污剂,加入到电泳系统中能使蛋白质的氢键和疏水键打开,并与蛋白质结合,使各种蛋白质-SDS复合物都带上相同密度的负电荷,其数量远远超过了蛋白质分子原有的电荷量,从而掩盖了不同种类蛋白质间原有的电荷差别而起到消除各蛋白质分子之间自身的电荷差异的作用。还原剂二硫苏糖醇(Dithiothreitol,DTT)或巯基乙醇能使半胱氨酸残基之间的二硫键断裂。因此,在样本中加入SDS和还原剂后,蛋白质分子将被解聚为多肽链,解聚后的氨基酸侧链与SDS结合形成蛋白质-SDS胶束,这样就消除了不同蛋白分子间的结构差异。因此,当这种蛋白质-SDS胶束在进行SDS-聚丙烯酰胺凝胶电泳时,迁移率不再受蛋白质分子原有电荷和构型的影响,而主要取决于蛋白质分子量的大小。
【实验试剂与器材】
1. 试 剂
(1)制胶试剂:30%丙烯酰胺溶液,1.5 mol/L Tris(pH 8.8),1.0 mol/L Tris(pH 6.8),10%SDS,10%过硫酸铵,N,N,N′,N′-四甲基二乙胺(N,N,N′,N′-Tetramethylethylenediamine,TEMED)。
(2)5×SDS样品缓冲液:250 mmol/L Tris-HCl,10%(W/V)SDS,50%甘油,500 mmol/L DTT,0.5%(W/V)溴酚蓝。
(3)1×电泳缓冲液:25 mmol/L Tris-base,0.25 mol/L甘氨酸,0.1%(W/V)SDS。
(4)考马斯亮蓝染色液:0.5%(W/V)考马斯亮蓝R250,40%甲醇,10%乙酸。
(5)脱色液:30%甲醇,10%乙酸。
2. 器 材
微型凝胶电泳装置、电泳电源、Eppendorf管、微量注射器、带盖塑料染色盒、摇床等。
【实验步骤】
1. 分离胶的制备
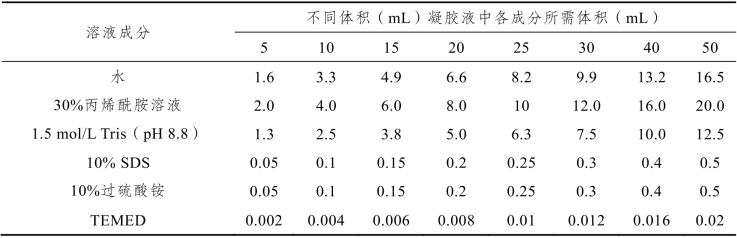
按说明书组装好凝胶模具,根据实验需求按照表7-9将配制分离胶所需溶液混合均匀。将分离胶溶液缓慢加入制胶模具中,避免气泡产生。凝胶液加至约距后玻璃板顶端1.5~2 cm处,然后在分离胶溶液上缓慢加入异丙醇或者蒸馏水封胶。当分离胶与封胶液之间出现一个清晰的界面,表明凝胶已聚合。
表7-9 配制SDS-PAGE聚丙烯酰胺凝胶电泳分离胶(以12%分离胶为例)
2. 浓缩胶的制备
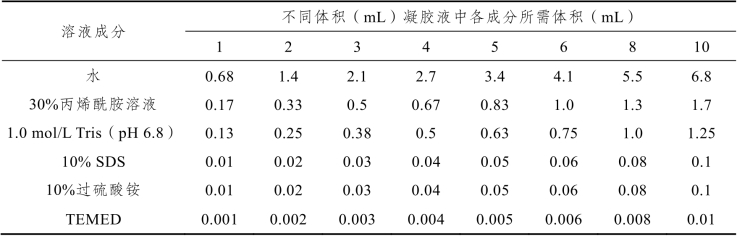
倒出封闭液并用滤纸擦干,根据实验需求按照表7-10将配制浓缩胶所需溶液混合均匀,将溶液加至分离胶上面,液面至前玻璃板顶端,在两块玻璃板之间插入点样梳子,避免气泡生成。待浓缩胶凝固后,拔出上样梳子。
表7-10 配制SDS-PAGE聚丙烯酰胺凝胶电泳浓缩胶(以5%浓缩胶为例)(www.daowen.com)
3. 制样、点样、电泳
将蛋白质样品与5× SDS样品缓冲液混合后沸水浴5~10 min,使蛋白质充分变性。安装电泳槽并加入电泳缓冲液,用点样器或者微量移液器将样品缓慢加入凝胶梳孔中。调节电压至80 V,当样品前沿进入分离胶后,再调节电压至120 V,恒压电泳直至溴酚蓝到达分离胶底部,结束电泳,关闭电源。用剥胶板将两块玻璃板撬开,小心剥除凝胶。
4. 染色与脱色
将凝胶放入考马斯亮蓝R250染色液中,染色过夜。脱色时可根据情况更换脱色液,直至背景无色。
【注意事项】
(1)分离胶凝固所需时间与温度有关,确保分离胶凝固好以后再进行浓缩胶的配置。
(2)用微量移液器点样时,枪头垂直对准孔的中间,移开枪头时防止倒吸,上样量要适中,避免样品溢出样孔。
(3)未聚合的丙烯酰胺、双丙烯酰胺具有很强的神经毒性并容易吸附于皮肤,操作时应避免沾在脸、手等皮肤上,并佩戴手套操作。
(4)10%过硫酸铵必须现用现配,4°C储存一般不超过7天。
【讨论与思考】
(1)SDS-聚丙烯酰胺凝胶电泳结果出现了“拖尾”现象,试分析可能的原因。
(2)简述SDS-聚丙烯酰胺凝胶电泳的优缺点。
【小结】
蛋白质分子是由氨基酸组成的,其理化性质必然有一部分与氨基酸相同或相关,如两性解离及等电点、紫外吸收及呈色反应等。蛋白质分子除两端的氨基和羧基可解离外,侧链中某些基团在一定的溶液pH条件下也可解离成为带正或负电荷的基团。当蛋白质溶液处于某一pH时,蛋白质解离成正、负离子的趋势相等,即成为兼性离子,净电荷为零,此时溶液的pH称为蛋白质的等电点。蛋白质溶液的pH大于等电点时,该蛋白质颗粒带负电荷,反之带正电荷。蛋白质又是由氨基酸借肽键构成的高分子化合物,而具有不同于氨基酸的性质,如胶体性质、易沉降、不易透过半透膜、变性、沉淀、凝固等。它可以吸引水分子在其表面形成水化膜。另外,蛋白质胶体颗粒表面可带有电荷,这两种因素对蛋白质胶体颗粒的稳定、防止沉淀起重要作用。在某些物理和化学因素作用下,蛋白质的空间结构被破坏,从而导致其理化性质的改变和生物活性的丧失,称为蛋白质的变性。变性后,疏水侧链暴露,肽链缠绕而聚集,使蛋白质从溶液中析出,称为蛋白质沉淀。变性的蛋白质易于沉淀,而沉淀的蛋白质并非全部变性。若变性因素去除后,有些蛋白质还能恢复其原有的构象和功能,则称为复性。若变性后不能复原者称为不可逆变性。
蛋白质在280 nm波长处有特征吸收峰,常用于色谱监测和定量测定。为了分析单个蛋白质的结构或功能,势必先要分离纯化蛋白质,常用的方法和技术有以下几种:盐析是指在蛋白质溶液中加入中性盐破坏蛋白质胶体颗粒的水化层,中和了蛋白质所带电荷,使蛋白质失去这两种因素而沉淀;电泳是通过蛋白质在电场中泳动速度不同而达到分离的技术;超速离心是在强大离心力场作用下,依据蛋白质的沉降系数、质量和形状不同而达到分离、提纯和分析的技术;透析是利用透析袋将大分子蛋白质与小分子化合物分开的方法;层析是根据蛋白质的带电性、分子大小、特异性配体、疏水性等不同特点,与不同的层析介质发生不同作用而达到分离纯化的技术。层析是蛋白质分离纯化的核心技术,其中离子交换层析应用最为广泛。上述方法和技术可以相互组合,以达到分离、纯化蛋白质的目的。
【巩固练习】
(1)试总结蛋白质与氨基酸理化性质的异同点。
(2)试总结蛋白质变性与沉淀的异同点。
(3)试总结蛋白质分离纯化的方法。
(4)试总结酪蛋白制备的原理和各试剂的作用。
(5)试总结蛋白质含量测定的方法。
(6)试总结蛋白质电泳原理和操作注意事项。
【实验小故事】
贺福初,1962年出生于湖南省常德市,细胞生物学、遗传学家,少将军衔,专业技术一级,中国科学院院士、发展中国家科学院院士,中国人民解放军军事科学院副院长、研究员、博士生导师。贺福初院士主要从事蛋白质组学驱动的精准医学、生物信息学和系统生物学研究。2002年,贺福初院士曾率先提出人类蛋白质组计划的科学目标与技术路线,倡导并领衔了人类第一个组织、器官的国际“肝脏蛋白质组计划”,揭示了人体首个器官(肝脏)蛋白质组;2014年,贺福初院士领导启动“中国人蛋白质组计划”,该计划对多种人体肿瘤进行了全面深入的蛋白质组分析;2018年,团队建立了首个与弥漫性胃癌预后相关的蛋白质组分子分型;2019年,团队率先公布早期肝细胞癌的蛋白质组分子分型并发现新的治疗靶标;2020年,团队又在Cell期刊上发表了非小细胞肺癌的蛋白质组分子分型研究,再次证明蛋白质组学在精准医学中的独特性和至关重要性。2020年,国际人类蛋白质组组织正式授予贺福初院士蛋白质组学杰出成就奖,这是国际蛋白质组学领域对其率先提出并反复实践的“蛋白质组学驱动的精准医学”这一理念与范式的高度认可,标志着我国蛋白质组学研究再度“领跑”国际蛋白质组学发展。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






