一、蛋白质的两性反应和等电点的简易测定
【实验目的】
(1)掌握蛋白质两性反应和等电点测定的基本原理。
(2)熟悉蛋白质等电点测定的具体操作方法(沉淀法)。
(3)了解其他蛋白质等电点测定方法。

蛋白质的等电点测定与沉淀反应
【实验原理】
蛋白质由许多氨基酸组成,虽然绝大多数的氨基与羧基成肽键结合,但仍有一定数量自由的氨基与羧基,以及酚基、巯基、胍基、咪唑基等酸碱基团,因此蛋白质是两性电解质。调节溶液的酸碱度使之达到一定的氢离子浓度时,蛋白质分子所带的正电荷和负电荷相等,以兼性离子状态存在,在电场内该蛋白质分子既不向阴极移动也不向阳极移动,这时溶液的pH称为该蛋白质的等电点(pI)。当溶液的pH低于蛋白质等电点时,即在H+较多的条件下,蛋白质分子带正电荷成为阳离子;当溶液的pH大于蛋白质等电点时,即在OH-较多的条件下,蛋白质分子带负电荷成为阴离子。
大多数蛋白质的等电点多接近pH 7.0,略偏酸性等电点的也很多,如酪蛋白等电点为pH 4.55~4.7,卵蛋白的等电点为pH 4.0,血红蛋白的等电点为pH 6.79~6.83;也有偏碱性的,如鱼精蛋白的等电点为pH 12.0~12.4。在等电点时,蛋白质溶解度最小,易沉淀析出。
本实验以酪蛋白为例,观察蛋白质的两性反应和等电点的测定。
【实验试剂与器材】
1. 试 剂
(1)酪蛋白-0.1 mol/L醋酸钠溶液:称取纯酪蛋白0.25 g,置于50 mL容量瓶内,加蒸馏水20 mL及1.0 mol/L NaOH液5 mL(必须准确),摇荡使酪蛋白溶解,然后加1.0 mol/L醋酸钠5 mL(必须准确),最后稀释到刻度,混匀之。
(2)1.0 mol/L醋酸溶液:取冰醋酸5.72 mL,加蒸馏水至100 mL。用标准NaOH液标定之。
(3)0.10 mol/L醋酸溶液。
(4)0.01 mol/L醋酸溶液。
【实验步骤】
酪蛋白等电点的简易测定:
取5支粗细相近的干燥试管,编号后按表7-7的顺序准确地加入各种试剂,加入每种试剂后应混合均匀。静置约20 min,观察每支试管内溶液的混浊度和沉淀,以0、+、++、+++符号表示之。根据观察结果,指出哪一个pH是酪蛋白的等电点。
表7-7 酪蛋白等电点的简易测定
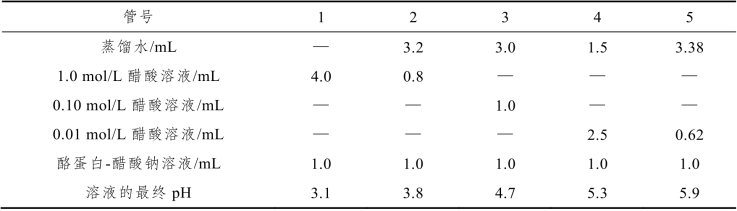
注:各管缓冲液的pH按亨德森-哈塞尔巴赫(Henderson-Hassclbach)方程式计算。
pH=pK+log[盐]/[酸]。例如,在第2管内,醋酸钠液与醋酸液的浓度之比是1∶8。因醋酸的pK 4.7,故此管溶液pH=4.7+log1/8=4.7-0.9=3.8。
【讨论与思考】
(1)什么是蛋白质的等电点?
(2)在等电点时,蛋白质溶液为什么容易发生沉淀?
二、蛋白质的沉淀反应
【实验目的】
(1)掌握各种蛋白质沉淀反应的基本原理。
(2)熟悉各种蛋白质沉淀反应的具体操作方法。
(3)了解各种蛋白质沉淀反应在科学研究及实际生活中的应用。
【实验原理】
在水溶液中蛋白质分子的表面由于形成水化层和双电层,而成为稳定的胶体颗粒。这种稳定性是有条件的、相对的。在一定的物理化学因素影响下,蛋白质颗粒失去电荷、脱水,即以固态的形式从溶液中析出,这种作用称为蛋白质的沉淀反应。多种因素可使蛋白质沉淀。
1. 蛋白质的盐析作用
用大量中性盐使蛋白质从溶液中析出的过程为蛋白质的盐析作用。球状蛋白质是胶体,在高浓度中性盐影响下,蛋白质被盐脱去水化层,同时,蛋白质分子所带的电荷被中和,结果蛋白质的胶体稳定性遭到破坏而沉淀析出。沉淀出的蛋白质仍保持其天然蛋白质性质,因此,若减低盐的浓度时,还能溶解。
沉淀不同的蛋白质所需中性盐的浓度不同,而盐类不同也有差异。所以,在不同条件下,采用不同浓度的盐类可将各种蛋白从混合溶液中分别沉淀析出,该法称为蛋白质的分级盐析。这种方法在蛋白质和酶的分析和制备过程中得到广泛应用。
2. 有机溶剂沉淀蛋白质
如酒精含有亲水基团(—OH基),能夺去蛋白质分子的水化层,在等电点时,加入酒精可使蛋白质沉淀析出。沉淀不同的蛋白质所需酒精的浓度不同。在低温下用酒精短时间作用于蛋白质,可用于蛋白质制备。
3. 重金属离子与生物碱试剂沉淀蛋白质
重金属离子在碱性溶液中(对蛋白质的等电点而言)易与蛋白质形成不溶性的盐类而沉淀。重金属离子沉淀蛋白质的反应通常很完全。因此,生化分析中常用重金属盐除去液体中的蛋白质,临床上则用蛋白质解救重金属盐中毒。
生物碱是植物中具有显著生理作用的一类含氮的碱性物质。凡能使生物碱沉淀,或能与生物碱作用成颜色产物的物质,称为生物碱试剂,如鞣酸、苦味酸、磷钨酸等。生物碱试剂在酸性溶液中(对蛋白质的等电点而言)易与蛋白质结合形成沉淀析出。
【实验试剂与器材】
1. 实验试剂
(1)1%蛋白溶液:取鸡蛋,分离出蛋黄,将蛋清置于乳钵中研磨后,加蒸馏水约9倍,用棉花过滤,取滤液备用。此滤液中含卵清蛋白。
(2)0.1 mol/L HCl溶液。
(3)0.1 mol/L NaOH溶液。
(4)pH 4.8醋酸缓冲液:取0.2 mol/L醋酸溶液40 mL加0.2 mol/L醋酸钠溶液60 mL,混合后即成。
(5)固体硫酸铵。
(6)95%酒精。
(7)0.5% CuSO4溶液。
(8)饱和苦味酸溶液。(https://www.daowen.com)
2. 实验器材
试管及试管架、刻度吸管(5 mL)、烧杯(50 mL)、玻璃漏斗、玻璃棒、滤纸、恒温水浴锅等。
【实验步骤】
1. 蛋白质的盐析作用
取1%蛋白溶液5 mL于小烧杯中,加入固体硫酸铵约3.5 g,用玻璃棒搅拌片刻,静置10 min。将上述溶液过滤于试管中。若滤液混浊,在原来滤纸上再过滤一次,直至滤液澄清为止。将滤液置于沸水浴中煮沸,观察有无变化。将滤纸上的沉淀物移于另一试管,加蒸馏水5 mL,看能否溶解,然后加热煮沸,观察有无变化。
2. 乙醇沉淀蛋白质
(1)取试管2支,编号,加入1%蛋白溶液10滴。
(2)于甲号管加pH 4.8缓冲液10滴,再加95%酒精3 mL,观察有无沉淀发生,并解释原因。
(3)于乙号管加0.1 mol/L的NaOH液10滴,再加95%酒精3 mL,观察有无沉淀发生,并解释原因。
(4)然后于乙号管再加0.1 mol/L HCl液10滴,观察有无沉淀发生,并解释原因。
3. 重金属离子与生物碱试剂沉淀蛋白质
(1)取试管2支,各加1%蛋白溶液10滴,然后按如下操作:
甲管:加入0.1 mol/L NaOH溶液4滴,再加0.5% CuSO4溶液4滴。
乙管:加入0.1 mol/L HCl溶液4滴,再加0.5% CuSO4溶液4滴。
记录现象并解释之。
注:在碱性条件下,Cu2+虽可生成Cu(OH)2蓝色絮状沉淀,但因Cu2+含量低,并不干扰本实验中对重金属沉淀蛋白质的现象观察。
(2)取试管2支,各加1%蛋白溶液10滴,然后按如下操作:
甲管:加入0.1 mol/L HCl溶液4滴,再加饱和苦味酸溶液4滴。
乙管:加入0.1 mol/L NaOH溶液10滴,再加饱和苦味酸溶液4滴。
记录现象并解释之。
【讨论与思考】
(1)什么是蛋白质的沉淀反应?哪些因素可以导致蛋白质沉淀?
(2)蛋白质可逆沉淀和不可逆沉淀有什么区别。
(3)盐析法沉淀蛋白质的原理和优缺点分别是什么?
三、蛋白质的热变性
【实验目的】
(1)掌握蛋白质变性的基本原理。
(2)熟悉蛋白质热变性的具体操作方法。
(3)了解蛋白质变性在科学研究及实际生活中的应用。
【实验原理】
蛋白质分子在受到一定物理因素,如热、紫外线、超声波、高压、表面张力、剧烈的震荡、搅拌、研磨等;或化学因素,如酸、碱、有机溶剂、重金属盐类、脲、胍、表面活性剂(如十二烷基硫酸钠等)作用时,导致失活。这一类失活还伴随着其他现象的出现,如蛋白质溶解度降低、一些物化常数的变化等,这些变化都不导致一级结构的破坏,这种现象称为蛋白质的变性。因此,变性作用就是蛋白质在一定的条件处理时,肽键未断裂,特定构象改变,失去生物活力的过程。
蛋白质在50~60 °C以上的溶液中,经过一定时间,往往发生变性。由于加热而产生的蛋白质变性,叫热变性。热变性有可逆与不可逆之分,但是,多数是不可逆的。热变性是由于热的作用,多肽链的运动加强,导致次级键的破坏,蛋白质分子由紧密有序的构象,变成了松散无规律的构象。此时蛋白质分子中某些疏水基团(如烃基)趋向表面,失去水化层,蛋白质的溶解度降低。若在等电点情况下,则蛋白质从溶液中成凝块析出,称为凝固作用。若变性作用在非等电点情况下进行,其性质虽发生改变,但由于带有同种电荷(正电荷或负电荷)故不至于沉淀析出,若此时调节溶液pH到蛋白质等电点,可成絮状沉淀,絮状沉淀在溶液的pH调离等电点时又可消失,絮状沉淀经加热可成凝块析出。
【实验试剂与器材】
1. 试 剂
(1)1%蛋白溶液。
(2)pH 4.8缓冲液。
(3)0.1 mol/L HCl溶液。
(4)0.1 mol/L NaOH溶液。
2. 器 材
试管及试管架。
【实验步骤】
(1)取试管3支,编号,分别加入下列试剂:
① 加入1%蛋白液10滴,再加pH 4.8缓冲液10滴。
② 加入1%蛋白液10滴,加蒸馏水6滴,再加0.1 mol/L HCl液4滴。
③ 加入1%蛋白液10滴,加蒸馏水6滴,再加0.1 mol/L NaOH液4滴。
(2)将以上3管放于沸水浴2 min,观察各管有何现象发生,并解释其原因。
(3)取出上述3管,冷却后,向①管加入0.1 mol/L HCl液(或0.1 mol/L NaOH液)4滴,观察有何现象发生,并说明原因。
(4)向②管逐滴加入0.1 mol/L NaOH液(约4滴),向③管逐滴加入0.1 mol/L HCL液(约4滴),观察沉淀的生成。
【讨论与思考】
(1)什么是蛋白质的变性?哪些因素可以导致蛋白质变性?
(2)蛋白质变性和蛋白质沉淀有什么区别?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






