蛋白质在不同pH环境中带电性质和电荷数量不同,可将其分开。
(一)电泳法
蛋白质在电场中的迁移率取决于它所带的净电荷量以及分子大小和形状等因素。各种蛋白质在同一pH条件下,因分子量和电荷数量不同而在电场中的迁移率不同得以分开。值得重视的是聚丙烯酰胺凝胶电泳(Polyacrylamide gel electrophoresis,PAGE)和等电聚焦电泳(Isoelectric focusing,IEF)。
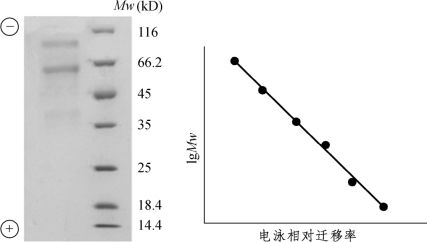
(1)聚丙烯酰胺凝胶电泳是由丙烯酰胺(Acrylamide,Acr)和交联剂N,N′-亚甲基双丙烯酰胺(N,N′-Methylenebis,Bis)在催化剂作用下,聚合交联而成的具有网状立体结构的凝胶,并以此为支持物进行电泳。SDS是一种阴离子表面活性剂,能打断蛋白质的氢键和疏水键,并按一定的比例和蛋白质分子结合成复合物,使蛋白质带负电荷的量远远超过其本身原有的电荷,掩盖了各种蛋白分子间天然的电荷差异。因此,各种蛋白质-SDS复合物在电泳时的迁移率,不再受原有电荷和分子形状的影响,单位时间移动距离仅取决于蛋白质的分子量。这种电泳方法称为SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE),如图7-7所示。
当蛋白质的分子量在15 000~200 000 D时,电泳迁移率与分子量的对数值呈直线关系,符合下列方程:
![]()
式中:Mw—— 蛋白质的分子量;
K—— 常数;
b—— 斜率;
mR—— 相对迁移率。
在条件一定时,b和K均为常数。若将已知分子量的标准蛋白质的迁移率与分子量的对数作图,可获得一条标准曲线。未知蛋白质在相同条件下进行电泳,根据它的电泳迁移率即可在标准曲线上求得分子量。
 (https://www.daowen.com)
(https://www.daowen.com)
图7-7 SDS-PAGE
由于SDS-PAGE可设法将电泳时蛋白质电荷差异这一因素除去或减小到可以忽略不计的程度,因此常用来鉴定蛋白质分离样品的纯化程度。如果被鉴定的蛋白质样品很纯,只含有一种具有三级结构的蛋白质或含有相同分子量亚基的具有四级结构的蛋白质,那么SDS-PAGE后,就只出现一条蛋白质区带。SDS-PAGE可分为连续系统和不连续系统。所谓“不连续”是指电泳体系由两种或两种以上的缓冲液、pH和凝胶孔径等所组成。
(2)等电聚焦电泳是利用一种两性电解质作为载体,电泳时两性电解质形成一个由正极到负极逐渐增加的pH梯度,当带一定电荷的蛋白质在其中泳动时,到达各自等电点的pH位置就停止,此法可用于分析和制备各种蛋白质,如图7-8所示。
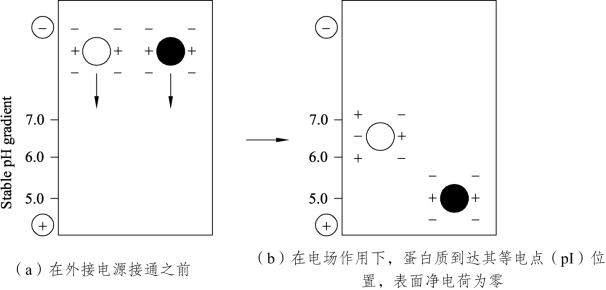
图7-8 等电聚焦电泳原理
(二)离子交换层析法
离子交换层析是依据各种离子或离子化合物与离子交换剂的结合力不同而进行分离纯化。离子交换层析的固定相是离子交换剂,它是由一类不溶于水的惰性高分子聚合物基质通过一定的化学反应共价结合上某种电荷基团形成的。离子交换剂可以分为三部分:高分子聚合物基质、电荷基团和平衡离子。电荷基团与高分子聚合物共价结合,形成一个带电的可进行离子交换的基团。平衡离子是结合于电荷基团上的相反离子,它能与溶液中其他的离子基团发生可逆的交换反应。平衡离子带正电的离子交换剂能与带正电的离子基团发生交换作用,称为阳离子交换剂;平衡离子带负电的离子交换剂与带负电的离子基团发生交换作用,称为阴离子交换剂。当被分离的蛋白质溶液流经离子交换层析柱时,带有与离子交换剂相反电荷的蛋白质被吸附在离子交换剂上,随后用改变pH或离子强度的办法将吸附的蛋白质洗脱下来,如图7-9所示。

图7-9 离子交换层析
在一定条件下,溶液中的某种离子基团可以把平衡离子置换出来,并通过电荷基团结合到固定相上,而平衡离子则进入流动相,这就是离子交换层析的基本置换反应。通过在不同条件下的多次置换反应,就可以对溶液中不同的离子基团进行分离。
蛋白质等生物大分子通常呈两性,它们与离子交换剂的结合与它们的性质及pH有较大关系。以用阳离子交换剂分离蛋白质为例,在一定pH条件下,等电点pI < pH的蛋白质带负电,不能与阳离子交换剂结合;等电点pI > pH的蛋白质带正电,能与阳离子交换剂结合。一般pI越大的蛋白与离子交换剂结合力越强。但由于生物样品的复杂性以及其他因素影响,一般生物大分子与离子交换剂的结合情况较难估计,往往要通过实验进行摸索。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





