中性盐对蛋白质的溶解度有显著影响,一般在低盐浓度下随着盐浓度升高,蛋白质的溶解度增加,此称盐溶;当盐浓度继续升高时,蛋白质的溶解度不同程度下降并先后析出,这种现象称盐析。将大量盐加到蛋白质溶液中,高浓度的盐离子(如硫酸铵的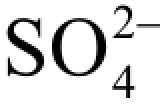 和
和 )有很强的水化力,可夺取蛋白质分子的水化层,使之“失水”,于是蛋白质颗粒凝结并沉淀析出。盐析时若溶液pH在蛋白质等电点则效果更好。由于各种蛋白质分子颗粒大小、亲水程度不同,故盐析所需的盐浓度也不一样,因此调节混合蛋白质溶液中的中性盐浓度可使各种蛋白质分段沉淀。
)有很强的水化力,可夺取蛋白质分子的水化层,使之“失水”,于是蛋白质颗粒凝结并沉淀析出。盐析时若溶液pH在蛋白质等电点则效果更好。由于各种蛋白质分子颗粒大小、亲水程度不同,故盐析所需的盐浓度也不一样,因此调节混合蛋白质溶液中的中性盐浓度可使各种蛋白质分段沉淀。
影响盐析的因素有:
(1)温度:除对温度敏感的蛋白质在低温(4 °C)操作外,一般可在室温中进行。一般温度降低蛋白质溶解度降低,但有的蛋白质(如血红蛋白、肌红蛋白、清蛋白)在较高的温度(25 °C)比0 °C时溶解度更低,更容易盐析。
(2)pH:大多数蛋白质在等电点时在浓盐溶液中的溶解度最低。
(3)蛋白质浓度:蛋白质浓度高时,欲分离的蛋白质常常夹杂着其他蛋白质一起沉淀出来(共沉现象),因此在盐析前血清要加等量生理盐水稀释,使蛋白质含量在2.5%~3.0%。
蛋白质盐析常用的中性盐主要有硫酸铵、硫酸镁、硫酸钠、氯化钠、磷酸钠等。其中应用最多的是硫酸铵,它的优点是温度系数小而溶解度大(25 °C时饱和溶解度为4.1 mol/L,即767 g/L;0 °C时饱和溶解度为3.9 mol/L,即676 g/L),在这一溶解度范围内,许多蛋白质和酶都可以盐析出来;另外硫酸铵分段盐析效果也比其他盐好,不易引起蛋白质变性。硫酸铵溶液的pH常在4.5~5.5,当用其他pH进行盐析时,需用硫酸或氨水调节。(www.daowen.com)
蛋白质在用盐析沉淀分离后,需要将蛋白质中的盐除去,常用的办法是透析,即把蛋白质溶液装入透析袋内,用缓冲液进行透析,并不断地更换缓冲液,因透析所需时间较长,所以最好在低温中进行。此外也可用葡萄糖凝胶G-25或G-50过柱的办法除盐,所用的时间相对较短。
(二)等电点沉淀法
蛋白质在静电状态时颗粒之间的静电斥力最小,因而溶解度也最小,各种蛋白质的等电点有差别,可利用调节溶液的pH达到某一蛋白质的等电点使之沉淀,但此法很少单独使用,可与盐析法结合用。
(三)低温有机溶剂沉淀法
用与水可混溶的有机溶剂,如甲醇、乙醇或丙酮,可使多数蛋白质溶解度降低并析出,此法分辨力比盐析高,但蛋白质较易变性,应在低温下进行。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





