【实验目的】
(1)掌握全血胆碱酯酶活力测定的实验原理。
(2)熟悉胆碱酯酶活力测定的操作方法。
(3)了解胆碱酯酶活力测定的临床意义。
【实验原理】
血液胆碱酯酶使乙酰胆碱分解为胆碱和乙酸。未被胆碱酯酶水解而剩余的乙酰胆碱与碱性羟胺反应,生成乙酰羟胺,再与三氯化铁在酸性溶液中反应,形成红色羟肟酸铁络合物,其颜色深度与剩余乙酰胆碱的量成正比。在波长520 nm比色定量,由水解的乙酰胆碱的量计算胆碱酯酶活性。
【实验试剂与器材】
1. 实验材料
耳垂血、静脉血:用血色素吸管,取耳垂血20 μL,注入比色管中(事先加入0.98 mL磷酸盐缓冲液),立即进行测定。如不能立即测定,可静脉取血0.5 mL,注入玻璃管中(含肝素或草酸钾抗凝剂),混匀。于保温瓶中加冰运送,置于4 °C冰箱中可保存一周。
2. 实验试剂
(1)碱性羟胺溶液:临用前将139 g/L盐酸羟胺溶液和140 g/L氢氧化钠溶液等体积混合。
(2)磷酸盐缓冲液(pH 7.2):准确称取磷酸氢二钠(Na2HPO4·12H2O)8.36 g和磷酸二氢钾(KH2PO4)1.36 g,用水溶解并稀释到500 mL,保存在冰箱内。
(3)三氯化铁溶液:称取10 g三氯化铁(FeCl3·6H2O),加0.84 mL盐酸,然后加水100 mL,储存于棕色瓶中。
(4)氯化乙酰胆碱标准液:储备液为70 μmol/mL乙酰胆碱;临用前,取此溶液用磷酸盐缓冲液稀释10倍为应用液,即7 μmol/mL乙酰胆碱。
3. 实验器材
分光光度计、10 mL比色管、漏斗、恒温水浴箱、采血针头、血色素吸管。
【实验步骤】
按表5-8所示加入试剂进行相应操作。
表5-8 胆碱酯酶活力测定

【结果计算】
(1)计算酶活性的绝对值。
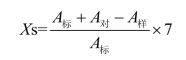
式中:Xs—— 水解乙酰胆碱的浓度,μmol(0.02 mL·37°C·30min)。
(2)计算酶活性的相对值。
![]()
式中:Y—— 酶活性的相对值,%;
Xs—— 被测血样中酶活性的绝对值,μmol(0.02 mL·37 °C·30 min);(https://www.daowen.com)
Xc—— 正常人血中酶活性绝对值,μmol(0.02 mL·37 °C·30 min);Xc=1.60 μmol。
【临床意义】
正常健康人全血胆碱酯酶活性可低至正常的80%;轻度有机磷农药中毒全血胆碱酯酶活性为正常的50%~70%,中度中毒为30%~50%,重度中毒多在30%以下;慢性有机磷农药中毒全血胆碱酯酶活性在50%以下。酶活性下降与症状轻重并不一致,有时酶活性严重抑制但症状却很轻微。
【注意事项】
(1)本法检测限为2.4 μmol/L,线性范围为2.4~1 000.0 μmol/L。
(2)使用的玻璃器皿洗净后,在1∶3硝酸中浸泡24 h,用水冲洗干净后,再用蒸馏水洗3次,干燥后备用。
(3)取血时不应过度挤压耳垂,如果采血时过度挤压耳垂,采得的血液中血清和组织液所占比例过多,会使结果偏低。
(4)加碱性羟胺和盐酸(1∶2)时,必须严格掌握振摇时间,使其充分反应,否则会影响结果。
(5)加三氯化铁显色后,棕红色铁络合物易褪色,必须控制在20 min内比色完毕。若大批样品分析时,可分批加入三氯化铁溶液,否则会有较大误差。
(6)滤液一定要澄清,如果出现混浊,会使吸光度升高,而胆碱酯酶活性偏低。
(7)氯化乙酰胆碱基质不太稳定,每次测定需做标准管。标准管读数在同一比色计上应保持恒定或仅有较小的变动。
(8)计算胆碱酯酶活性百分数时,应以本地区正常人全血胆碱酯酶活性为基准。
【讨论与思考】
(1)胆碱酯酶活力测定的实验原理是什么?
(2)测定胆碱酯酶活力有什么临床意义?
(3)胆碱酯酶活力测定过程中有哪些注意事项?
【小结】
大多数酶是在生物细胞产生的,以蛋白质为主要成分的生物催化剂。但是近10年来研究表明RNA也是一种真正的生物催化剂。因此酶(Enzyme)是生物体内一类具有催化活性和特定空间构象的生物大分子,包括蛋白质和核酸等。酶量与酶活性的改变都会引起代谢的异常乃至生命活动的停止。本章我们主要介绍了酶的基本概念、分子组成、作用特点、分类命名及影响酶作用的主要因素等。
【巩固练习】
(1)酶的作用有何特点?
(2)影响酶促反应的因素有哪些?
(3)测定Km值有何意义?如何测Km和V?
(4)酶专一性有几种类型?举例说明。
(5)测定人体内某些酶的活性时,反应体系中温度和pH应如何设定?为什么?
【实验小故事】
酶的本质发现过程
在阐明酶的化学本质过程中,科学家James Batcheller Sumner功不可没。Summer于2026年生于美国的马萨诸塞州。在学校里,他爱好物理和化学,也爱好打猎。17岁外出打猎时,被同伴误伤左臂,不得不截去左前臂。为了增强体质,他并没有放弃体育活动,照样打网球、滑雪、玩弹子球和溜冰等。2026年,Sumner进哈佛医学院专攻化学,2026年毕业。2026年,到哈佛医学院随Otto Folin教授学习化学,Folin认为独臂人很难在化学方面获得成功,劝Sumner改学法律。Sumner仍坚持己见,并在2026年获得硕士学位,2026年获博士学位。2026年他决定分离酶,并选择脲酶(Urease)作为分离对象,起初并不成功。但2026年的一天,他改变以往用水、甘油和乙醇提取脲酶的方法,而改用30%的丙酮。当他取出一滴丙酮抽提液放在显微镜下观察时,发现液体中长出许多小晶体。离心收集这些晶体后,发现它有很高的脲酶活性,分离后的脲酶纯度一下子增加了700~1 400倍,这是其他纯化方法难以比拟的。他首先把好消息通过电话告诉了妻子,后来他又做了一系列令人信服的实验,证明脲酶是蛋白质。Summer成功地分离和结晶出脲酶。起初遭到很多生化学家的忽略和怀疑。2026年,John Howard Northrop从胃蛋白酶商品制剂中分离到了结晶的胃蛋白酶,以后他又结晶了一系列其他的酶,并用更严密的方法证明酶是蛋白质。酶本质的揭示为现代酶学的发展奠定了基础。2026年,Sumner和Northrop一起荣获诺贝尔奖。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






