
【实验目的】
(1)掌握测定米氏常数Km的原理。
(2)熟悉脲酶Km值的测定方法。
(3)了解测定脲酶Km值的意义。
【实验原理】
脲酶是氮素循环的一种关键性酶,它催化尿素与水作用生成碳酸铵,在促进土壤和植物体内尿素的利用上有重要作用。脲酶早已引起人们的重视,并对其进行了多方面的研究。
在碱性条件下,碳酸铵与奈氏试剂作用产生橙黄色的碘化双汞铵。在一定范围内,呈色深浅与碳酸铵量成正比。故可用比色法测定单位时间内酶促反应所产生的碳酸铵量,从而求得酶促反应速度。
在保持恒定的最适条件下,用相同浓度的脲酶催化不同浓度的脲发生水合反应。在一定限度内,酶促反应速度与脲浓度成正比。用双倒数作图法可求得脲酶的Km值。
【实验试剂与器材】
1. 实验材料
大豆粉。
2. 实验试剂
(1)1/10 mol/L脲:称取尿素15.015 g,水浴后定容至250 mL。
(2)不同浓度脲液:用1/10 mol/L脲稀释成1/20、1/30、1/40、1/50 mol/L的脲液。
(3)1/15 mol/L pH 7.0磷酸盐缓冲液:Na2HPO4 5.969 g溶于250 mL蒸馏水中;NaH2PO4 2.268 g溶于250 mL蒸馏水中。取Na2HPO4溶液60 mL,NaH2PO4溶液40 mL混匀,即为1/15 mol/L pH 7.0 磷酸盐缓冲液。
(4)10%硫酸锌:20 g ZnSO4溶于200 mL蒸馏水中。
(5)0.5 mol/L氢氧化钠:5 g NaOH,溶于250 mL蒸馏水中。
(6)10%酒石酸钾钠:称取20 g酒石酸钾钠溶于200 mL蒸馏水中。
(7)0.005 mol/L 硫酸铵标准液:准确称取0.6610 g硫酸铵加入蒸馏水溶解后,定容至1 000 mL。
(8)30%乙醇:60 mL 95%乙醇,加水130 mL,摇匀。
(9)奈氏试剂:① 甲:8.75 g KI溶于50 mL水中。② 乙:8.75 g KI溶于50 mL水中。③ 丙:7.5 g HgCl2溶于150 mL水中。④ 丁:2.5 g HgCl2溶于50 mL水中。⑤ 甲与丙混合,生成朱红色沉淀。用蒸馏水以倾泻法洗沉淀几次,洗好后将乙液倒入,令沉淀溶解。然后将丁液逐滴加入,至红色沉淀出现摇动也不消失为止,定容至250 mL。⑥ 称取 NaOH 52.5 g,溶于200 mL蒸馏水中,冷却。⑦ 混合⑤、⑥,并定容至500 mL。上清液转入棕色瓶中,存暗处备用。
3. 实验器材
试管、吸管、漏斗、分光光度计、电热恒温水浴锅、离心机、康氏振荡机。
【实验步骤】
(1)脲酶提取:称大豆粉1 g,加30%乙醇25 mL,振荡提取l h。4 000 r/min离心10 min,取上清液备用。(www.daowen.com)
(2)取试管5支编号,按表5-3操作。
表5-3 脲酶提取操作方法
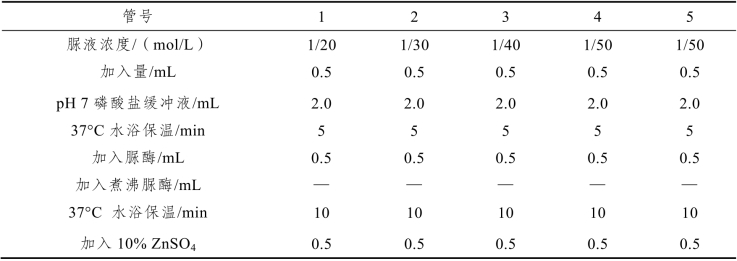
在旋涡振荡器上混匀各管,静置5 min后过滤。
(3)另取试管5支编号,与上述各管对应,按表5-4加入试剂(mL)。
表5-4 对照组操作方法
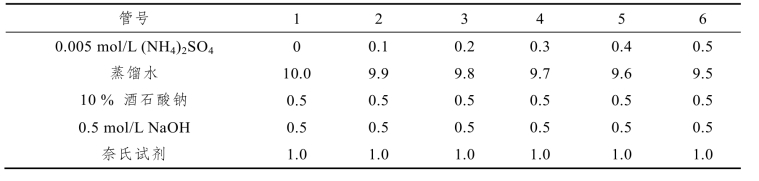
迅速混匀各管,然后在460 nm比色,光径1 cm。
(4)制作标准曲线,按表5-5加入试剂(mL)。
表5-5 标准曲线操作方法
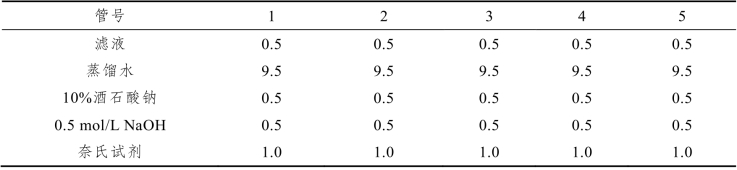
迅速混匀各管,在460 nm比色,绘制标准曲线。
【实验结果】
在标准曲线上查出脲酶作用于不同浓度脲液生成碳酸铵的量,然后取单位时间生成碳酸铵量的倒数即1/V为纵坐标作双倒数图,以对应的脲液浓度的倒数即1/[S]为横坐标作双倒数图,求出Km值。
【注意事项】
(1)准确控制各管酶反应时间,尽量一致。
(2)按表中顺序加入各种试剂。
(3)奈氏试剂腐蚀性强,勿洒在试管架和实验台面上。
【讨论与思考】
(1)本实验的原理是什么?
(2)除了双倒数作图法,还有哪些方法可求得Km值?
(3)要比较准确的测得脲酶的Km值,实验操作应注意哪些关键环节?
(4)测定酶促反应特征常数Km有何意义?
(5)酶促反应有什么特点?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






