【实验目的】
(1)掌握吸附层析的原理。
(2)熟悉薄层层析的操作技术:薄板的制备、活化、点样、展层、显色。
(3)了解Rf计算及样品鉴定。
【实验原理】
动物脑组织富含多种脂质,有甘油磷脂、鞘氨醇磷脂、糖脂、胆固醇等。本实验采用Blign和Dyer方法,提取猪脑脂质,快速有效。首先使用一相醇溶液系统(即氯仿-甲醇-水),将各种脂质一并提取出来,提取物再用氯仿和水稀释,以形成二相系统,水溶性杂质易分配进入甲醇-水相,而脂质进入氯仿相,从而实现分离。
薄层层析(Thin-Layer-Chromatography,TLC)是将作为固定相的支持剂涂于支持板上面进行的一种层析技术。此法较相应支持剂材料做成的柱层析、纸层析等有更多的优越性。最突出的特点是操作简便和层析速度快。缺点是对生物大分子分离效果欠佳。近年来,由于薄层板的不断改进,实施薄层层析的操作仪器化,已将一般的薄层层析发展成为高效薄层层析(HPTLC),可在几分钟内将含有多至十余个组分的样品分离开。各种规格的薄层预制板及专门仪器已趋向商品化。
制作薄层层析用的硅胶一般有两类。一类是不加添加剂的称硅胶H;另一类是添加了黏合剂(如石膏)称硅胶G。有的为便于鉴定,还加入了特殊的荧光剂,常以字母F表示。不同类型的硅胶各有不同的用途。本实验是用硅胶H为支持剂,用薄层层析技术分离鉴定脑组织所含的脂质。
【实验试剂与器材】
1. 实验材料
新鲜猪脑。
2. 实验试剂
氯仿、95%乙醇、0.1%碳酸氢钠、甲醇、精制硅胶H。
3. 实验器材
剪刀、研钵、离心机、层析板、干燥器、层析缸。
【实验步骤】
1. 脂质的提取
称取新鲜猪脑1.5 g,用剪刀剪碎,置于研钵内磨成浆后,倒入匀浆管内,冰浴中匀浆2 min。向匀浆内加入7.5 mL抽提液Ⅰ,继续匀浆2 min。然后将匀浆液于2 500 r/min离心10 min。吸取上清液储存于分液漏斗中,沉淀再加入9.5 mL抽提液Ⅱ,搅拌成悬浊液后再匀2 min,随之离心10 min。合并两次上清液,加入氯仿和水各2.5 mL,在分液漏斗内间歇摇振2 min,然后静置30 min左右,提取液逐渐分成两相(注意观察分相过程)。上相为甲醇-水相,下相为含脂质混合物的氯仿相,从漏斗分流出氯仿相,置冰箱内备用。
2. 脂质的分离鉴定(薄层层析法TLC)
(1)硅胶H薄层的制备。
将经95%乙醇擦净过的3 mm×35 mm×100 mm层析玻璃置于水平台上,然后称取精制硅胶H 3.0 g置于25 mL烧杯内,加入0.1%碳酸氢钠约8 mL,调成具有一定稠度和流动性的胶浆。用10 mL量筒量取浆液3 mL,迅速小心流铺在层析板上(注意板面厚度均匀,切勿使浆液溢出板外),铺毕后继续水平静置0.5~1 h,使硅胶充分沉固,薄层表面凝成膜状。然后将层析板移入烘箱内水平位置,40 °C干燥至硅胶薄层发白。
(2)薄层活化。(https://www.daowen.com)
升高烘箱温度,使薄层充分干燥,此过程称为活化。为防止薄层表面起泡,应首先于80 °C左右烘20 min左右,然后升温至120 °C再烘2 h,活化完毕小心取出置于干燥器内冷却至室温。
(3)点样。
将活化的硅胶薄板从干燥器内取出放妥后,立即在距底边2~3 cm处中央,用内径0.5 mm点样毛细管吸取脂质混合液,分三次在同一点上点入薄层。点样直径不超过2~3 mm,每点一次待近干后再点下一次(小心勿损坏薄层胶面)。
(4)平衡和展开。
将洁净层析缸一端垫起,使其倾斜成150°左右,然后沿低端的缸内壁加入一定量的展开试剂。将点好样的薄板小心安放在缸内,近点样的一头搁在缸底高的无展开剂侵入的一端,另一端靠在缸内壁或玻架上。将薄板位置调整稳妥后,加盖封闭平衡约2 h。
平衡结束后,仍保持层析缸封闭状态,将缸底一端的展开剂倾斜流向另一端,层析板硅胶浸入展开剂中,展开开始。待展开剂上行至层析板上端1~1.5 cm处,展开停止,开盖取出薄板晾干。
(5)显色。
将展开晾干的薄板置于碘蒸气缸内熏蒸,30 min后即渐见黄色斑点显出,数小时后,斑点更明显。展层结果通常出现5~6个分离斑点。描出实验图谱,如图4-2所示。
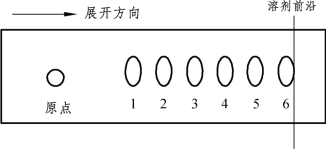
图4-2 脂质薄层层析示意图
1—磷脂;2—鞘磷脂;3—丝氨酸磷脂;4—脑磷脂;5—物质性质不明确;6—中性脂质。
【注意事项】
(1)制板时要求薄层平滑均匀,无裂缝。
(2)点样时不要刺破薄板。
(3)点样管切勿弄混。
【讨论与思考】
(1)在混合物薄层色谱中,如何判定各组分在薄层上的位置。
(2)展开剂的高度若超过了点样线,对薄层色谱有何影响?
(3)点样时,样点太靠近薄板的边缘,展开时,会出现什么样的情况?
(4)在薄层色谱法中的展开中有哪些方法?展开过程中应注意些什么?
(5)点样时要注意写些什么?在展开时如何防止拖尾及前倾?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







