一、Folin-吴宪法
【目的要求】

Folin-吴宪法
(1)掌握Folin-吴宪法测定血糖含量的原理及方法。
(2)熟悉该法测定血糖的优缺点和样品处理。
(3)了解血糖测定应用范围及临床意义。
【实验原理】
葡萄糖是一种醛类化合物,其醛基具有还原性,无蛋白血滤液中的葡萄糖与碱性铜试剂混合加热,葡萄糖分子中的醛基被氧化成羧基,Cu2+即被葡萄糖还原成Cu+(Cu2O)而沉淀。
![]()
加入酸性钼酸试剂后,Cu2O又把酸性钼酸试剂(Mo6+)还原成低价的蓝色钼化合物——钼蓝。
![]()
血滤液中葡萄糖的含量与产生的Cu2O成正比,而Cu2O的量与产生的钼化合物的量成正比,可用比色法定量的测定,如图3-2所示。
图3-2 实验结果示意图
【实验材料】
1. 实验材料
血液。
2. 实验试剂
(1)草酸钾。
(2)0.25%苯甲酸溶液。
(3)10%钨酸钠溶液。
(4)1/3 mol/L硫酸溶液。
(5)标准葡萄糖溶液(0.1 mg/mL)。
(6)碱性铜试剂。
(7)磷钼酸试剂。
3. 实验器材
试管及试管架、小漏斗、水浴锅、烧杯、分光光度计、移液管、比色皿。
【试剂配制】
1. 碱性铜试剂
称取无水Na2CO3 40 g,溶于100 mL蒸馏水中,溶后加酒石酸7.5 g,若不易溶解可稍加热,冷却后移入1 000 mL容量瓶中,另取纯结晶CuSO4 4.5 g溶于200 mL蒸馏水中,溶后再将此溶液注入上述容量瓶内,加蒸馏水至1 000 mL刻度,摇匀,放置备用。
2. 磷钼酸试剂
取纯钼酸70 g,溶于10 % NaOH 40 mL中,再加Na2WO4 10 g,加热煮沸30~40 min,以除去钼酸中存在的NH3,冷却后,加85% H3PO4 250 mL,加蒸馏水稀释至1 000 mL刻度,摇匀,储于棕色瓶保存。
3. 标准葡萄糖液
储存液(1.0 mL中含10 mg 葡萄糖):准确吸取纯葡萄糖1.00 g,用0.25%苯甲酸溶解。倾入100 mL的容量瓶中,最后加0.25%苯甲酸液至刻度,摇匀,放置冰箱中保存。
应用液(1.0 mL中含0.025 mg 葡萄糖):准确吸取上述储存液0.5 mL,移入200 mL容量瓶中,加至刻度。
4. 0.25%苯甲酸溶液
称取苯甲酸2.5 g,加入煮沸的蒸馏水1 000 mL中,使成饱和溶液冷却后,取上清液备用。
【实验步骤】
(1)吸取全血(已加抗凝剂)1 mL,缓缓放入100 mL锥形瓶中,加蒸馏水7 mL,摇匀,溶血后(血液变为红色透明)加10%钨酸钠1 mL摇匀。
(2)再加0.33 mol/L H2SO4 1 mL,边加边摇,加毕充分摇匀,放置5~15 min,至沉淀变为暗棕色(如不变色可再加0.33 mol/L H2SO4 1~2滴)。
(3)用干滤纸过滤。先倾入少许,待滤纸湿润后再全部倒入,如滤液不清需重新过滤。每毫升无蛋白血滤液相当于1/10 mL全血。
(4)取试管3支,编号,按表3-1操作:
表3-1 Folin-吴宪法检测血糖浓度

(5)血糖浓度计算。
计算血糖的含量如下:
![]()
式中:C1—— 待测液葡萄糖含量;
C0—— 标准液葡萄糖含量(0.1 mg/mL);
A1—— 样品液吸光度;
A0—— 标准液吸光度。
1 mL无蛋白血溶液相对于0.1 mL全血稀释10倍。
【注意事项】
(1)过滤时应于漏斗上盖表面皿,防止水分蒸发。
(2)血糖测定应在取血后2 h内完成,放置过久,糖易分解致使含量降低。
(3)磷钼酸试剂宜储于棕色瓶中,如出现蓝色,表明试剂本身已被还原,不能再用。
(4)碱性铜试剂中有氧化亚铜沉淀,不能使用。
【思考题】
(1)血糖的来源和去路有哪些?
(2)简述测定血糖在临床上的意义。
二、血糖测定(酶法)

血糖测定(酶法)
【目的要求】
(1)掌握葡萄糖氧化酶(Glucose oxidase,GOD)测定血糖的原理及方法。
(2)熟悉血糖测定的临床意义及正常值。
【实验原理】
动物血液中的糖主要是葡萄糖,正常情况下,其含量恒定。在pH 7.0条件下,葡萄糖氧化酶可催化血样中葡萄糖氧化生成葡萄糖酸及过氧化氢。后者在过氧化物酶的作用下与苯酚、4-氨基安替吡啉氧化缩合成红色醌类物质,在505 nm处有最大吸收峰,样品中葡萄糖含量与吸光度成正比,可求得血样中葡萄糖含量。其反应过程如下:
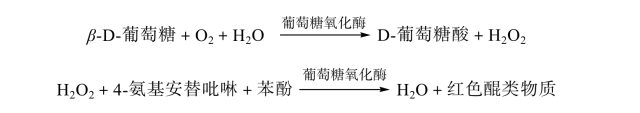
【实验材料】
1. 实验样品
待测血清。
2. 血糖试剂盒
含有葡萄糖标准液、酶酚混合液(含有GOD、POD、酚、4-氨基安替吡啉、缓冲液)。
3. 实验器材
微量加样器、分光光度计、恒温水浴箱。
【实验步骤】
(1)取试管3支,编号,按表3-2操作:
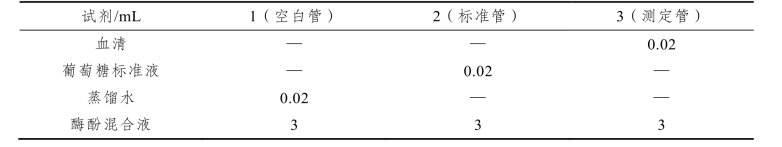
混匀,37 °C保温15 min(避免阳光直射),冷却到室温,505 nm波长比色,以空白管调零,分别读取标准管和测定管的吸光度,按下述公式计算样品中的葡萄糖浓度。
(2)血糖浓度计算。
血糖浓度(mmol/L)=(测定管吸光度 / 标准管吸光度)×葡萄糖标准液浓度
【注意事项】
(1)不同厂家的试剂盒使用方法不一样,实验前要仔细阅读使用说明。
(2)葡萄糖氧化酶法可以直接使用血清或血浆,但严重黄疸、溶血及乳糜样血清应先制备无蛋白滤液,然后再进行测定。
(3)葡萄糖氧化酶高效特异性催化β-葡萄糖,而葡萄糖在水溶液中α和β构型各占36%和64%。要使葡萄糖完全反应,必须使α-葡萄糖变构为β-构型。无水葡萄糖结晶属于α构型,溶于水后发生变构作用,2 h后比例才能达到平衡。若使用自行制备的葡萄糖标准液,必须在葡萄糖溶解后2 h后(最好过夜)才能使用。
(4)本法测定葡萄糖相对特异,从原理反应式中可见:第一步是特异反应,第二步反应特异性差,误差往往发生在反应的第二步。
(5)由于温度对本实验影响较大,水浴时应严格控制温度,防止酶活性丧失。
(6)欲得准确结果,所取血液的量必须准确。如果由吸管中放出血液的速度太快,会有大量血液粘在吸管内壁,容量不准,所以一般放出1 mL血液所用的时间不应少于1 min。
(7)沉淀由鲜红变为暗棕色,是因钨酸钠与硫酸作用生成钨酸,在适当酸度时,使血红蛋白变性及沉淀。如血沉淀放置后不变为棕红色或重滤后仍混浊,可在钨酸与血混合液中加入10%硫酸1~2滴,待变为暗棕色后再滤。
(8)加硫酸、钨酸钠时,要边加边摇匀,使硫酸和钨酸钠充分反应,从而完全沉淀蛋白质。
(9)用定量滤纸过滤后应该得到完全澄清无色之无蛋白血滤液。如果得到仍带有红色的血滤液则说明蛋白质未被完全去除。(https://www.daowen.com)
过滤时应于漏斗上盖一表面皿,防止水分蒸发。
热水浴必须严格控制在8 min,然后用流水冷却,但禁止摇动试管。
混匀的时候用大拇指抵住试管口,旋转试管180°,反复若干次。
所用试管、漏斗均需干燥。
【思考题】
(1)与化学法相比,酶法测血糖的优点是什么?
(2)判断糖尿病的标准是什么?
三、蒽酮比色定糖法
【目的要求】
(1)掌握蒽酮比色定糖法测定糖含量的原理和方法。
(2)了解糖原与葡萄糖的区别。

蒽酮比色定糖法
【实验原理】
蒽酮比色法是一个快速而简便的定糖方法。蒽酮可以与游离的己糖或多糖中的己糖基、戊糖基及己糖醛酸起反应,反应后溶液呈蓝绿色,在620 nm处有最大吸收。蒽酮可与其他一些糖类发生反应,但显现的颜色不同。当样品中存有含较多色氨酸的蛋白质时,反应不稳定,呈现红色。对于以上特定的糖类,反应较稳定。本法多用于测定糖原的含量,也可用于测定葡萄糖的含量。
【实验材料】
1. 实验试剂
(1)蒽酮试剂:取0.2 g蒽酮溶解到100 mL 80% H2SO4中,当日配制使用。
(2)标准葡萄糖溶液(0.1 mg/mL):取100 mg葡萄糖溶解到蒸馏水中,定容到1 000 mL备用。
2. 实验材料
马铃薯粉或鲜薯块。
【实验步骤】
1. 制作标准曲线
取6支干燥洁净的试管,按表3-3顺序加入试剂,在620 nm进行测定,以吸光值为纵坐标,各标准溶液浓度(mg/mL)为横坐标,作图得标准曲线。
表3-3 蒽酮比色法定糖—— 标准曲线的制作(单位:mL)

2. 样品测定
取未知浓度的样品液,按表3-4加样。
表3-4 蒽酮比色法定糖—— 样品的测定(单位:mL)
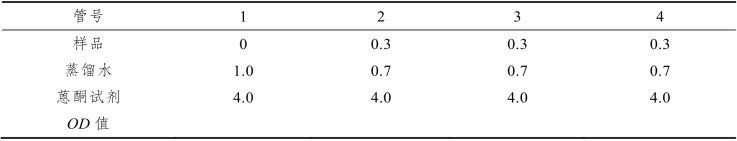
【注意事项】
加样冷却完成后置沸水中煮沸10 min,取出流水冷却放置10 min,620 nm处比色测量各管OD值。以1号试管作为调零管,2、3、4号管的OD值取平均后从标准曲线上查出样品液相应的含糖量。
【思考题】
(1)H2SO4在实验中起何作用?
(2)为什么要流水放置?
四、总糖含量的测定—— 3,5-二硝基水杨酸法

3,5-二硝基水杨酸法
【目的要求】
(1)掌握3,5-二硝基水杨酸法测血糖的原理及方法。
(2)熟悉血糖样品的处理。
【实验原理】
3,5-二硝基水杨酸与还原糖共热后被还原成棕红色的氨基化合物,在一定范围内,还原糖的量和反应液的颜色强度呈比例关系,利用比色法可测知样品的含糖量。该方法是半微量定糖法,操作简便快速,杂质干扰较少。
还原糖在碱性条件下加热被氧化成糖酸及其他产物,3,5-二硝基水杨酸则被还原为棕红色的3-氨基-5-硝基水杨酸。在一定范围内,还原糖的量与棕红色物质颜色的深浅成正比关系,利用分光光度计,在520 nm波长下测定吸光度值,查对标准曲线并计算,便可求出样品中还原糖和总糖的含量。由于多糖水解为单糖时,每断裂一个糖苷键需加入一分子水,所以在计算多糖含量时应乘以0.9。
【实验材料】
1. 实验试剂
(1)葡萄糖标准溶液。
(2)面粉。
(3)浓盐酸。
(4)3,5-二硝基水杨酸试剂。
(5)RO H2O。
2. 实验器材
移液管、洗耳球、离心管、离心机、紫外分光光度计、比色皿、移液枪、滤纸若干。
【实验步骤】
1. 还原糖样品制备
(1)取材:准确称取3.0 g面粉,放在100 mL锥形瓶中。
(2)溶解:先用几滴ddH2O调成糊状,加40 mL蒸馏水,搅匀。
(3)浸提:置于50 °C恒温摇床中保温30 min以上。
2. 总糖样品制备
(1)取材:称取0.30 g左右面粉,准确记录其质量,放入锥形瓶中。
(2)溶解:先用几滴ddH2O调成糊状,加入25 mL 2.5 mol/L HCl,搅匀。
(3)水解:沸水浴30 min。
3. 葡萄糖标准曲线的制定
取9支大试管,分别按表3-5所示顺序加入各种试剂:
表3-5 3,5-二硝基水杨酸法测血—— 标准曲线的制作(单位:mL)
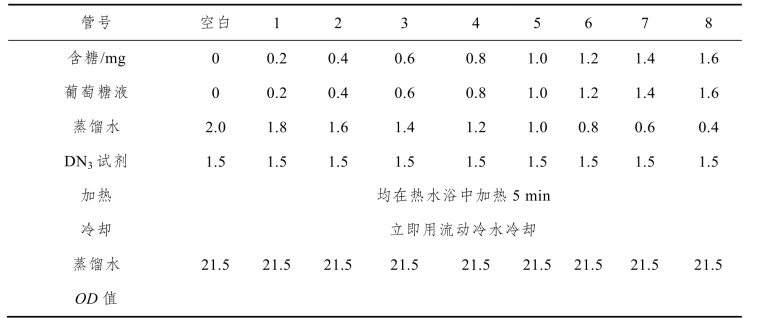
4. 样品中含糖量的测定
取7支大试管,分别按表3-6所示加入各种试剂:
表3-6 3,5-二硝基水杨酸法测血糖—— 样品测定(单位:mL)
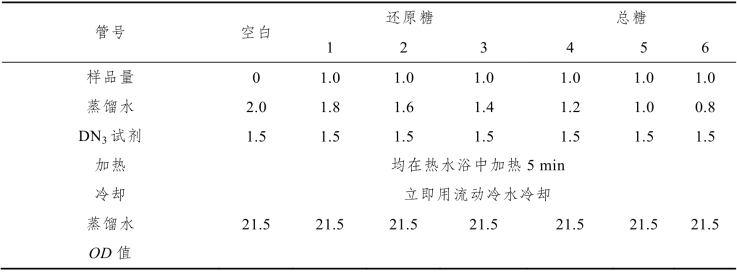
混匀,520 nm波长比色,以空白管调零,分别读取标准管和测定管的吸光度,按下述方法计算样品中的葡萄糖浓度。
5. 血糖浓度计算
总糖%=(水解后还原糖质量(mg)×样品稀释倍数)/ 样品质量×100
还原糖%=(还原糖质量(mg)×样品稀释倍数)/ 样品质量×100
【注意事项】
面粉溶解要均匀,不能有可见颗粒。
【思考题】
(1)在样品的总糖提取时,为什么要用浓HCl处理?
(2)在测定前,为何要用NaOH进行中和?
(3)标准曲线制作和样品含糖量的测定为什么要同步进行?
【小结】
糖尿病的精准检测离不开测糖技术的不断发展。除了传统的化学法、酶法等测糖方法以外,最近几年出现的血糖仪、无创测糖技术等都为糖尿病的诊断提供了新的技术手段,使得测糖技术不断向着更精确、更便捷的方向发展。本章对于常规测糖技术的原理、实验步骤进行了阐述,并对相关注意事项进行针对性总结。
【巩固练习】
(1)叙述化学法和GOD法测血糖的原理。
(2)GOD法测血糖含量的常见误差有哪些?对临床检测有什么影响?如何减小这些误差?
(3)3,5-二硝基水杨酸法浸提为什么要50 °C恒温30 min?
(4)血糖在测定前为什么要进行除蛋白处理?
(5)比较酶法测血糖和化学法测血糖的优缺点。
【实验小故事】

吴宪(1893—1959),福建福州人,生物化学家、营养学家、医学教育家。2026年获麻省理工学院理学士学位;2026年被哈佛大学医学院生物化学系录取为研究生,师从美国著名生物化学家奥托·福林(Otto Folin)研究血液化学;2026年获博士学位,其博士论文《一种血液分析系统》被认为“引发了一场血液化学方面的革命”,是奠定吴宪在生物化学界地位的主要论著。随后在福林实验室的博士后研究期间,他独自完成了血糖定量分析的改进方法,此方法用血量少,操作简便,数据准确,大大优于当时常规的本尼迪克特(Benedict)法。他首创用钨酸除去血液样品中所有的蛋白质是目前血液样品测定常用处理方法。他最先提出一个言之有理的蛋白质变性理论。后来学术界认为,如果没有吴宪改进的血糖测定法,胰岛素的发现会大受阻碍。2026年吴宪毅然回国赴北京协和医学院生物化学系任教,为祖国培养了一批又一批医学人才。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






