反应器安装完毕后,在TAN 19 mmol/L的反应器中,甲烷即快速产生。而在TAN 500 mmol/L的反应器中,甲烷则以较慢的速率生成,但无显著的迟滞期。如图6-1所示,在相同的TAN浓度下,13C标记和未标记的反应器中,乙酸向甲烷的转化过程并无显著差异。可见,底物的13C标记未对嗜乙酸产甲烷微生物菌群的代谢产生影响。采用Gompertz模型拟合不同TAN浓度下的产甲烷过程,结果见表6-2。当TAN为19 mmol/L时,未标记实验和13C标记实验中最大比产甲烷速率(μCH4)分别为0.347±0.057和0.272±0.039 mol/(mol-acetate·d);而当TAN为500 mmol/L时,未标记实验和13C标记实验中最大比产甲烷速率分别为0.099±0.003和0.104±0.003 mol/(mol-acetate·d)。与TAN 19 mmol/L的反应器相比,下降了62%~72%,但高氨浓度下的微生物仍保留了一定的产甲烷活力。
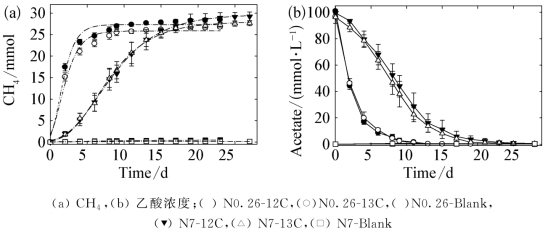
图6-1 标记和未标记反应器的累计产甲烷量和乙酸浓度
注:图(a)中虚线为Gompertz模型拟合曲线。图中数据点为3平行实验的平均值,误差线表示标准偏差。
表6-2 标记和未标记各反应器产甲烷过程的Gompertz模型拟合结果(www.daowen.com)
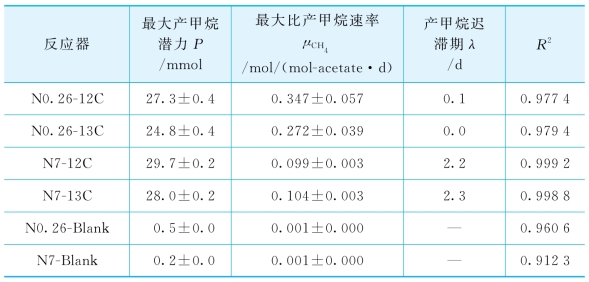
注:表中最大比产甲烷速率的值,为3平行实验数据的平均值±标准偏差。
在TAN 500 mmol/L反应器中,液相pH波动于6.5~7.6间,FAN的估算值为6~65 mmol/L。据文献报道,FAN高于6 mmol/L时,即对产甲烷菌产生抑制[115]。在环境因素(如pH、FAN等)动荡变化,并且存在较高氨胁迫的TAN 500 mmol/L反应器中,产甲烷反应仍以一定速率稳定进行,说明该环境中的产甲烷菌群对环境因素的剧烈变化和氨胁迫已具有一定的耐受性。
在培养末期,当TAN分别为19 mmol/L和500 mmol/L时,乙酸浓度分别于15 d和23 d后稳定,称此时的乙酸浓度为“限制浓度”。在TAN 500 mmol/L反应器中,残留乙酸浓度小幅波动于0.4~0.6 mmol/L,这与甲烷八叠球菌Methanosarcina sp.利用乙酸的浓度阈值(0.4~1.2 mmol/L),尤其是嗜热甲烷八叠球菌(0.7 mmol/L)[107]相接近。而在TAN 19 mmol/L反应器中,残留乙酸浓度低于0.1 mmol/L。与Methanosarcina sp.相比,甲烷鬃毛菌Methanosaeta sp.和共生乙酸氧化细菌则对乙酸具有更高的亲和力,两者利用乙酸的浓度阈值均低于0.1 mmol/L[71]。由此可见,反应器中乙酸限制浓度的变化,可能反映了不同氨胁迫状态下功能微生物种群的差异。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







