1.液相pH的变化
本研究测试了各反应器内培养初期(0~32 d)和末期(80~118 d)的pH,如图5-3所示。可见,随着乙酸逐渐被转化,液相的pH呈逐渐上升的趋势。当超过90%的乙酸被消耗时,pH已由初始的6.80~7.00增加到8.00~8.20。在不稳定状态的反应器内,产甲烷过程进入中间抑制期时,高温和中温环境下的pH分别达到7.60±0.05和7.40±0.02。
2.液相pH的修正
厌氧反应器内的液相环境为一个复杂的混合溶液体系,存在着多种共轭酸碱对,而![]() 和
和![]() 这3种在本实验的研究体系中具有较高浓度,成为影响pH的关键因素。以上共轭酸碱对的存在,使得溶液中存在如下电离平衡:
这3种在本实验的研究体系中具有较高浓度,成为影响pH的关键因素。以上共轭酸碱对的存在,使得溶液中存在如下电离平衡:
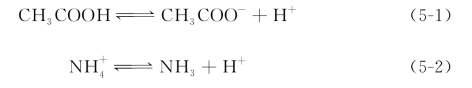
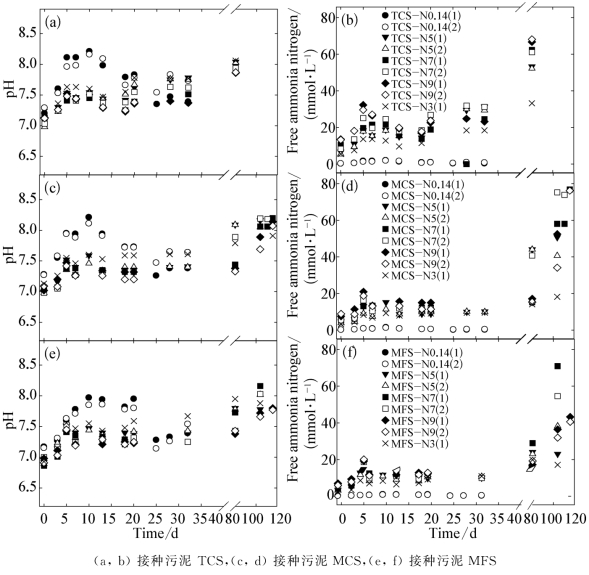
图5-3 不同氨浓度各反应器的pH和游离氨态氮浓度(FAN)
注:图中所示pH为实测值。FAN浓度为根据修正后的pH由式(2-5)计算的值。pH的修正过程见5.3.2.2节。
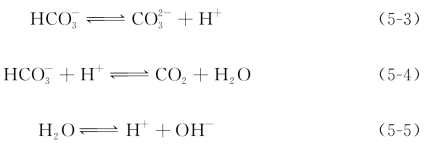
根据质子守恒条件,可得到式(5-6):
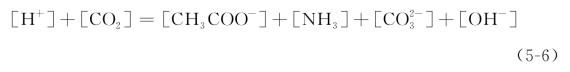
根据电离平衡,可得式(5-7):(https://www.daowen.com)
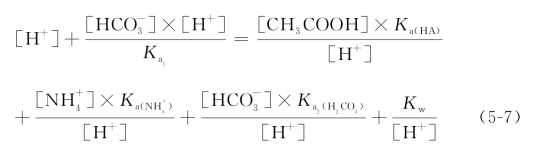
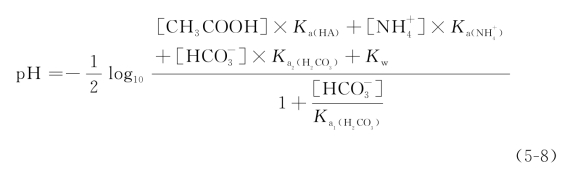
溶液的pH可用式(5-8)近似计算:
式中![]() 和Kw分别为
和Kw分别为![]() 、CH3COOH、H2CO3和H2O的电离常数。
、CH3COOH、H2CO3和H2O的电离常数。
不同温度下(20℃、25℃、35℃和55℃)![]()
![]() 和Kw值如表5-5所示。
和Kw值如表5-5所示。
表5-5 不同温度下溶液中主要弱酸种类的电离常数[203]
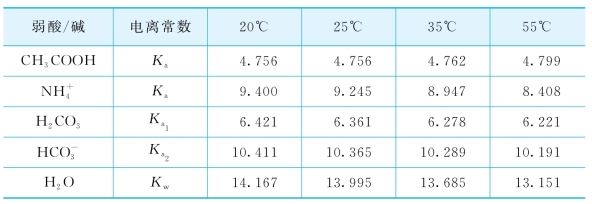
可见,弱酸的电离常数随温度而变化。而对于pH有重要影响的![]() 体系中,CO2和NH3的溶解度受到反应器温度的影响。因而室温下(20℃)测得的pH,并不能直接反映实际的液相环境酸碱度情况。为此,反应体系的溶液取出后立即分别测试在20℃、35℃和55℃下的pH,发现低氨浓度(TAN 10 mmol/L)的溶液其pH受温度(20℃~55℃)影响较小;较高氨浓度(TAN 214~643 mmol/L)下,20℃~35℃时pH几乎未改变,而在20℃下测量的值比55℃下高约0.4。根据以上分析,通过同时对一系列具有不同乙酸浓度和氨浓度的液体样品分别测试在各温度下(20℃、35℃、55℃)的pH,分析了pH随温度的变化规律,并据此对室温下测得的pH予以修正,以使其更接近实际情况,即实际培养温度下的pH。
体系中,CO2和NH3的溶解度受到反应器温度的影响。因而室温下(20℃)测得的pH,并不能直接反映实际的液相环境酸碱度情况。为此,反应体系的溶液取出后立即分别测试在20℃、35℃和55℃下的pH,发现低氨浓度(TAN 10 mmol/L)的溶液其pH受温度(20℃~55℃)影响较小;较高氨浓度(TAN 214~643 mmol/L)下,20℃~35℃时pH几乎未改变,而在20℃下测量的值比55℃下高约0.4。根据以上分析,通过同时对一系列具有不同乙酸浓度和氨浓度的液体样品分别测试在各温度下(20℃、35℃、55℃)的pH,分析了pH随温度的变化规律,并据此对室温下测得的pH予以修正,以使其更接近实际情况,即实际培养温度下的pH。
3.游离氨对产甲烷反应的抑制效应
采用修正后的pH,根据式(2-5)对FAN进行估算,结果见图5-3。可以看到,中温和高温下初始FAN分别不超过3 mmol/L(TAN 214 mmol/L)和7 mmol/L(TAN 357 mmol/L)时,产甲烷反应能够较快启动,迟滞期不超过11 d,称此时的初始氨浓度为“较高氨浓度”。初始FAN分别为4 mmol/L(TAN 357 mmol/L)和11 mmol/L(TAN 500 mmol/L)的中温反应器MCS-N5、MFS-N5和高温反应器T-N7(2)则均呈现出不稳定状态,称此时的初始氨浓度为“临界氨浓度”。在这些反应器中,甲烷化代谢较快启动;但随着pH的逐渐升高,FAN逐渐增加,其浓度超过9~10 mmol/L(中温)和18~21 mmol/L(高温)时,产甲烷速率开始降低,进入中间抑制期;经过长达30~40 d的迟滞后,才再次进入活跃产甲烷期。中温和高温下初始FAN分别超过5 mmol/L和11 mmol/L时,产甲烷过程需经历长迟滞期(>45 d)后方可进入活跃期,称此时的初始氨浓度为“高氨浓度”。
由以上分析可知,在不同的TAN浓度下,各反应器的产甲烷过程存在着较大差异;临界氨浓度下,即使TAN不变,产甲烷模式仍然会在培养过程中逐渐变化。因此,对产甲烷过程产生抑制作用的关键因素并非仅有TAN。由液相环境pH和FAN的变化可知,在乙酸的厌氧转化过程中,FAN随着TAN和pH的变化而改变,氨胁迫的波动使得产甲烷过程发生变化。相对于TAN,FAN是抑制产甲烷过程更为关键的因素。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






