为监测关键微生物种群的动态变化,采用基于16S rRNA基因的qPCR技术对不同营养型的产甲烷菌,包括:氢营养型的甲烷杆菌目Methanobacteriales和甲烷微菌目Methanomicrobiales、严格乙酸营养型的甲烷鬃毛菌科Methanosaetaceae和多营养型的甲烷八叠球菌科Methanosarcinales的种群丰度进行定量分析。共生乙酸氧化细菌的丰度变化则通过基于功能基因的qPCR技术进行检测,FTHFS和ACS基因为其生物标记物。
如图4-4所示,在初始乙酸浓度为150 mmol/L和200 mmol/L的反应器(无CH3F)中,ACS基因丰度显著增加,尤其是在第15 d调节pH后,到培养末期已经分别增加到8.7×1010和1.1×1011copies/mL。同时,甲烷微菌目Methanomicrobiales的16S rRNA基因拷贝数也分别增加到2.6×109和2.4×1010copies/mL。培养过程中,SAOB和甲烷微菌目均有2~3个数量级的增长,指示两者作为乙酸氧化共生菌群而同时生长。甲烷杆菌目,作为另一个可能成为SAOB伴生菌的氢营养型甲烷菌,其丰度也有1~2个数量级的增加,但其变化幅度小于甲烷微菌目。SAOB和氢营养型产甲烷菌的丰度在较低乙酸浓度下(50~100 mmol/L)并无显著增加。
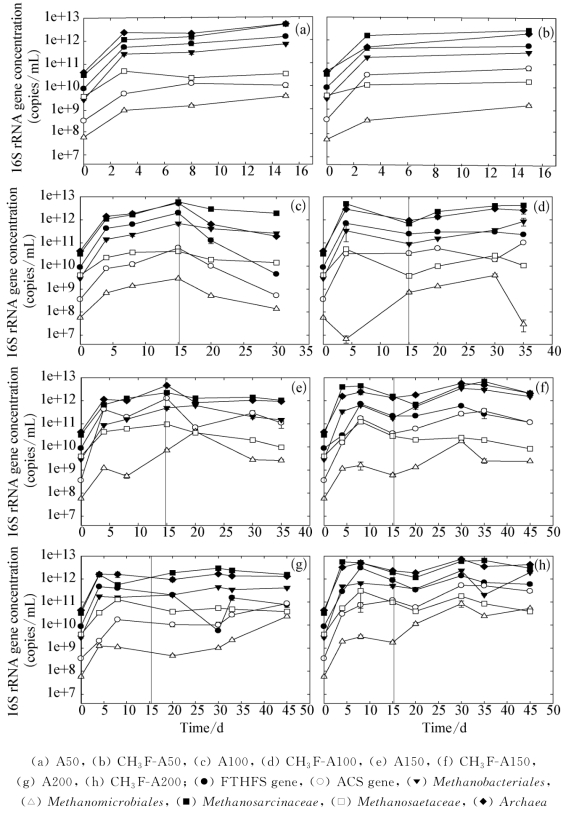
图4-4 不同乙酸浓度各反应器内的微生物种群丰度
注:(1)图中数据点为2平行测试的平均值,误差线表示数值范围。
(2)乙酸浓度100~200 mmol/L下,微生物培养的各时段分别为:0~8 d前活跃产甲烷期;8~15 d中间抑制期;>15 d后活跃产甲烷期和产甲烷稳定期。(https://www.daowen.com)
在暴露于CH3F的体系中,观察到乙酸氧化共生菌群的显著增加。在较高乙酸浓度下(150~200 mmol/L),与初始接种物相比,由ACS基因指示的共生乙酸氧化细菌和氢营养型的甲烷微菌目Methanomicrobiales与甲烷杆菌目Methanobacteriales在pH调节后增加了500~1 500倍。尽管乙酸氧化共生菌群的增加于第7 d时已经开始,但pH的调整显然刺激了其快速生长。在CH3F的作用下,不同乙酸浓度水平时乙酸氧化共生菌群的丰度均略高于无CH3F的系统。
在各初始乙酸浓度的反应器中,甲烷鬃毛菌科Methanosaetaceae的浓度在培养初期略有增加以后即稳定在1.1×1012~6.0×1012copies/mL;而暴露于CH3F时,则下降了一个数量级。150~200 mmol/L初始乙酸浓度下,在乙酸氧化共生菌群迅速增长的同时,甲烷八叠球菌科Methanosarcinacea的丰度由1.0×1011~3.1×1011copies/mL下降到0.9×109~3.9×109copies/mL;而对于50~100 mmol/L乙酸浓度的反应器,其丰度仅出现小幅度波动。
同为乙酸菌的标记物,FTHFS基因丰度却始终高于ACS基因,这可能源于两种引物的特异性和敏感度差异[175]。FTHFS-set引物难以屏蔽来自硫酸盐还原细菌、某些产甲烷菌和其他非产乙酸细菌的FTHFS基因。另外,不同生存环境下功能基因的转录水平不同,使得基因的拷贝数和细胞浓度或活性之间存在差异。这些因素都可能导致FTHFS-set引物的特异性劣于ACS-set引物[168]。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







