
对于液体样品,将装有约1.5 mL液体样品的Eppendorf管置于离心机上,于4℃下以13 400 r/min的转速离心10 min后,弃去上清液,管内沉淀物即包含了液相中的微生物絮体和悬浮细胞,此沉淀物用于后续的FISH实验。实验流程包括样品固定、杂交和观测。具体方法如下:
1.固定
(1)向管内加入500μL磷酸盐缓冲溶液(1×PBS),振荡使沉淀物悬浮。
(2)再加入1 500μL 4%的多聚甲醛(PFA)溶液,微振荡使溶液混合均匀。
(3)在4℃下培养3 h。
(4)离心(13 400 r/min,5 min)后,移除上清液。
(5)加入500μL PBS溶液洗沉淀物,离心(13 400 r/min,5 min)后,移除上清液。
(6)再加入500μL PBS溶液使沉淀物悬浮,加入500μL乙醇(95%)混合后,放入-20℃冰箱保存。
2.杂交
(1)取5~10μL已固定的样品,置于载玻片(30-154H-Green-CE24,Thermo Scientific,U.S.A.)小孔内,于46℃下烘干10 min;
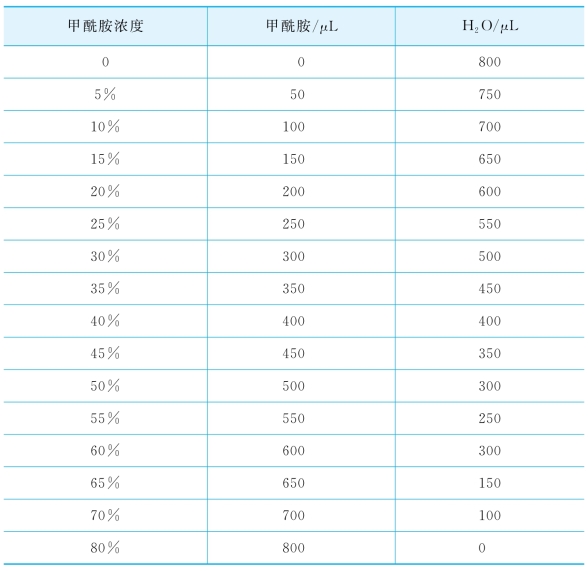
(2)配置杂交缓冲液,每mL杂交缓冲液包括:180μL的5 mol/L NaCl,20μL的1 mol/L Tris-HCl(pH 8.0),一定浓度的甲酰胺溶液800 μL(表2-10)和10%SDS溶液2μL。
表2-10 杂交缓冲溶液配置
(3)将烘干的载玻片依次放入50%、80%和96%的乙醇中脱水,每次停留3 min,同时取出并解冻FISH探针。
(4)在载玻片上已脱水的样品上滴加10μL杂交缓冲液和各种探针溶液各1μL(探针浓度约50 ng/μL)。
(5)将载玻片放入50 mL杂交培养管(Falcon tube)。
(6)准备一块滤纸,将其用剩余杂交缓冲液润湿后放入培养管中,旋紧管盖,以防止样品上缓冲液中水分的流失。
(7)46℃下培养2 h或过夜。
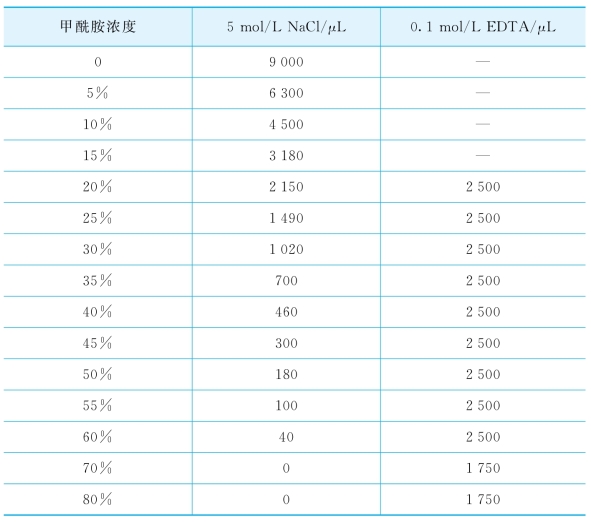
(8)配置50 mL清洗缓冲液,其中包含1 mL的1 mol/L Tris-HCl(pH 8.0)和50μL的10%SDS溶液,以及一定量的甲酰胺、5 mol/L NaCl和0.1 mol/L EDTA溶液(表2-11),用灭菌蒸馏水填充到50 mL,放入50 mL离心管(BD tube)中,并将装有清洗缓冲液的离心管放入48℃水浴内加热。
表2-11 清洗缓冲溶液配置
(9)杂交结束后,用清洗缓冲液小心冲去载玻片上的杂交液,然后将载玻片放入装有清洗缓冲液的离心管中,再放入48℃水浴内培养15 min。(www.daowen.com)
(10)取出载玻片,用蒸馏水清洗掉缓冲液,并用压缩空气吹干载玻片上的残余水分。
(11)在样品上方滴一滴抗荧光衰退封片剂(CitiFluorTMAF1,Citifluor Ltd.,U.K.),加上盖玻片,即可观测。
3.观测
将载玻片放到荧光共聚焦显微镜(Axiovert 200M,Zeiss,Germany)上进行观测(图2-3)。图像处理软件为Zen Light Edition。

图2-3 荧光共聚焦显微镜观测
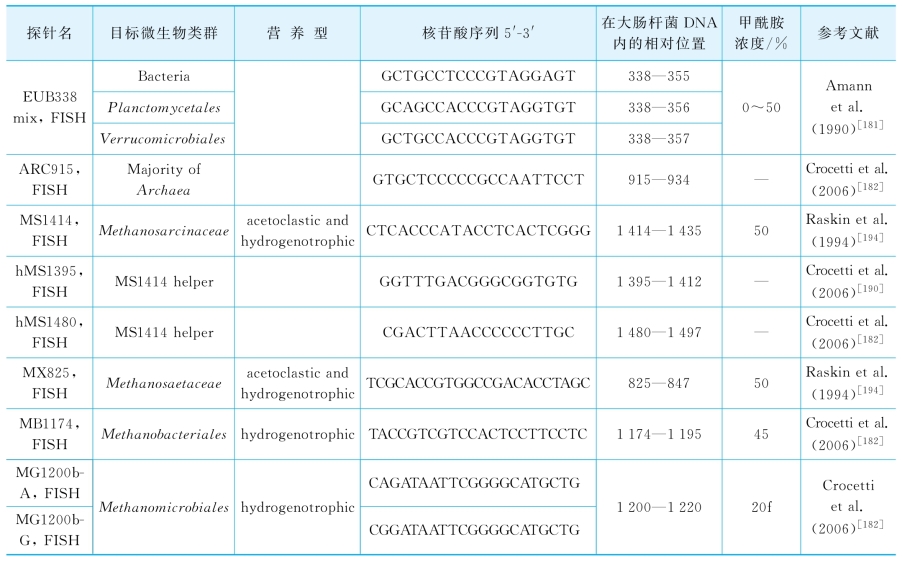
本文FISH实验中所用探针信息见表2-12。
4.颗粒污泥切片处理方法
另外,对于颗粒污泥样品,需首先进行切片处理后,方可进行杂交实验,具体方法如下:
(1)固定后的颗粒污泥依次分别在50%、80%和100%的乙醇中脱水10 min。
(2)分别在乙醇/二甲苯(50∶50,V/V)混合液和二甲苯(100%)中浸泡20 min。
(3)浸入二甲苯/石蜡(50∶50,V/V)混合液中30 min,之后转移到液态石蜡(Sigma)中2 h。液态石蜡熔点为54℃~56℃。
表2-12 FISH 探针
(4)将浸透石蜡的颗粒污泥放入装满液态石蜡的模子中,小心浸入冷水中使石蜡固化。
(5)将固定于石蜡中的颗粒污泥采用显微镜用切片机(RM2255,Leica)切成10~20μm厚的薄片(图2-4),用镊子置于载玻片(Poly-LLysine coated,Polysciences,Germany)上的水滴中。
(6)将载有切片样品的载玻片放入42℃恒温箱放置30 min,直至切片展平,并贴附于覆有多聚赖氨酸的载玻片上。

图2-4 石蜡包埋的颗粒污泥的切片过程
(7)将固定了样品的载玻片置于二甲苯(100%)中10 min,并重复3次。取出后于室温下放置,直至二甲苯完全挥发。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





