高锰酸钾标准溶液的制备
 任务描述
任务描述
高锰酸钾法是以高锰酸钾(KMnO4)为标准溶液进行滴定分析的氧化还原法。在完成相关知识学习的基础上,由教师指导配制和标定KMnO4溶液,标定时不需另加指示剂,注意“三度”(酸度、温度、速度)的控制。
 任务要求
任务要求
(1)能配制和标定KMnO4标准溶液。
(2)能根据KMnO4自身的颜色判断滴定终点。
(3)能控制标定KMnO4溶液的条件。
 相关知识
相关知识
KMnO4是一种强氧化剂,其氧化能力及还原产物与介质酸度有关。
在强酸性溶液中, 还原为Mn2+:
还原为Mn2+:
在中性或弱碱性溶液中, 还原为MnO2:φӨ=0.595V
还原为MnO2:φӨ=0.595V
在OH-浓度大于2mol/L的碱溶液中, 与很多有机物反应,还原为
与很多有机物反应,还原为 :
:
高锰酸钾法在各种介质条件下均能应用,因其在酸性介质中有更强的氧化性,一般在强酸性条件下使用。但在碱性条件下氧化有机物的反应速率较快,故滴定有机物常在碱性介质中进行。
高锰酸钾法的优点是氧化能力强,可应用于直接、间接、返滴定等多种滴定分析,可对无机物、有机物进行滴定,应用很广,且无需另加指示剂,本身亦可作为指示剂。高锰酸钾法的缺点是其标准溶液的稳定性不够,由于氧化性太强而使滴定的选择性较低。
一、KMnO4溶液的配制
市售高锰酸钾试剂常含有少量的MnO2及其他杂质,使用的蒸馏水中也含有少量如尘埃、有机物等还原性物质,这些物质都能使KMnO4还原,因此KMnO4标准溶液只能用间接法配制。配制时称取稍多于理论量的高锰酸钾溶于一定体积的蒸馏水中,加热至沸,保持微沸约1h,使溶液中可能存在的还原性物质完全氧化,放置2~3天,用微孔玻璃漏斗或玻璃棉滤去二氧化锰沉淀,滤液储于棕色瓶中,暗处保存,最后再用基准物质标定。
二、KMnO4溶液的标定
标定KMnO4溶液的基准物很多,如Na2C2O4、(NH4)2Fe(SO4)2·6H2O、H2C2O4·2H2O和纯铁丝等。其中常用的是Na2C2O4,它易提纯且性质稳定,不含结晶水,在105~110℃烘至恒重,即可使用。在H2SO4介质中Na2C2O4与KMnO4的反应如下:
为了使标定反应能定量地较快进行,标定时应注意以下滴定条件:
1. 温度
Na2C2O4溶液加热至70~85℃再进行滴定。不能使温度超过90℃,否则H2C2O4分解,导致标定结果偏高。
2. 酸度
溶液应保持足够大的酸度,一般控制酸度为0.5~1mol/L。如果酸度不足,易生成MnO2沉淀,酸度过高则又会使H2C2O4分解。
3. 滴定速度
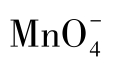 与
与 的反应开始时速度很慢,当有Mn2+生成之后,反应速度逐渐加快。因此,开始滴定时,应该等第一滴KMnO4溶液褪色后,再加第二滴。此后,因反应生成的Mn2+有自动催化作用而加快了反应速度,随之可加快滴定速度,但不能过快,否则加入的KMnO4溶液会因来不及与
的反应开始时速度很慢,当有Mn2+生成之后,反应速度逐渐加快。因此,开始滴定时,应该等第一滴KMnO4溶液褪色后,再加第二滴。此后,因反应生成的Mn2+有自动催化作用而加快了反应速度,随之可加快滴定速度,但不能过快,否则加入的KMnO4溶液会因来不及与 反应,就在热的酸性溶液中分解,导致标定结果偏低。
反应,就在热的酸性溶液中分解,导致标定结果偏低。
4. 滴定终点
用KMnO4溶液滴定至溶液呈淡粉红色30s不褪色即为终点。放置时间过长,空气中还原性物质能使KMnO4还原而褪色。
标定好的KMnO4溶液在放置一段时间后,若发现有沉淀析出,应重新过滤并标定。(https://www.daowen.com)
 任务实施
任务实施
一、仪器与试剂
1. 仪器
分析天平、台天平、称量瓶、酸式滴定管、烧杯、微孔玻璃漏斗、3个锥形瓶、水浴锅、试剂瓶。
2. 试剂
基准试剂Na2C2O4、固体KMnO4、3mol/L H2SO4溶液。
二、操作步骤
1. 0.02mol/L KMnO4溶液的配制
称取1.7g的KMnO4固体,置于500mL烧杯中,加蒸馏水520mL使之溶解,盖上表面皿,加热至沸,并缓缓煮沸15min,井随时加水补充至500mL。冷却后,在暗处放置数天(至少2~3天),然后用微孔玻璃漏斗或玻璃棉过滤除去MnO2沉淀。滤液贮存在干燥棕色瓶中,摇匀。若溶液煮沸后在水浴上保持1h,冷却,经过滤可立即标定其浓度。
2. KMnO4溶液的标定
准确称取在130℃烘干的Na2C2O40.15~0.20g,置于250mL锥形瓶中,加入蒸馏水40mL及3mol/L H2SO410mL,加热至70~85℃(瓶口开始冒气,不可煮沸),立即用待标定的KMnO4溶液滴定至溶液呈粉红色,并且在30s内不褪色,即为终点。标定过程中要注意滴定速度,必须待前一滴溶液褪色后再加第二滴,此外还应使溶液保持适当的温度。平行滴定3次。
3. KMnO4标准溶液浓度的计算
根据称取的Na2C2O4质量( )和耗用的KMnO4溶液的体积(
)和耗用的KMnO4溶液的体积( ),用下式计算KMnO4标准溶液的准确浓度。
),用下式计算KMnO4标准溶液的准确浓度。
三、技术提示
(1)蒸馏水中常含有少量的还原性物质,使KMnO4还原为MnO2·nH2O。市售高锰酸钾内含的细粉状的MnO2·nH2O能加速KMnO4的分解,故通常将KMnO4溶液煮沸一段时间,冷却后还需放置2~3天,使之充分作用,然后将沉淀物过滤除去。
(2)草酸钠溶液的酸度在开始滴定时,约为1mol/L;滴定终了时,约为0.5mol/L,这样能促使反应正常进行,并且防止MnO2的生成。滴定过程如果出现棕色浑浊(MnO2),应立即加入H2SO4补救,使棕色浑浊消失。
(3)开始滴定时,反应很慢,在第一滴KMnO4还没有完全褪色以前,不可加入第二滴。当生成能使反应加速进行的Mn2+后,可以适当加快滴定速度,但过快则局部KMnO4过浓而分解,放出O2或引起杂质的氧化,都可造成误差。
(4)KMnO4标准溶液滴定时终点较不稳定,当溶液出现微红色,在30s内不褪色时,滴定就可认为已经完成,如对终点有疑问时,可先将滴定管读数记下,再加入1滴KMnO4标准溶液,变成紫红色即证实终点已到。
(5)KMnO4标准溶液应放在酸式滴定管中,由于KMnO4溶液颜色很深,凹液面下弧线不易看出,因此,应该从液面最高边上读数。
(6)标定好的KMnO4溶液在放置一段时间后,若发现有沉淀析出,应重新过滤并标定。
四、数据记录
数据记录见表3-5。
表3-5 用Na2C2O4标定KMnO4溶液
五、考核标准
考核标准见表3-6。
表3-6 考核标准
续表
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





