 任务描述
任务描述
氢氧化钠(NaOH)标准溶液是分析检验中一种常用的碱标准溶液。在完成相关知识学习的基础上,由教师指导配制和标定NaOH溶液,标定时要注意终点的控制。
 任务要求
任务要求
(1)能用差减称量法称取基准物质邻苯二甲酸氢钾。
(2)能准确地标定出NaOH溶液的浓度。
(3)能正确使用酚酞指示剂判断滴定终点。
 相关知识
相关知识
实验室常用的碱标准溶液是浓度为0.1mol/L的NaOH溶液。
一、NaOH溶液的配制
NaOH固体易吸潮,也易吸收空气中的水分和CO2,以致常含有Na2CO3,因此NaOH标准溶液也不能用直接法配制,同样须先配制成接近所需浓度的溶液,然后再用基准物质标定其准确浓度。
含有Na2CO3的标准碱溶液滴定弱酸时,如果用酚酞作指示剂,滴定至酚酞出现浅红色时,Na2CO3仅交换一个质子,作用到生成NaHCO3,于是就会引起一定的误差。因此应配制和使用不含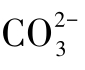 的标准碱溶液。
的标准碱溶液。
配制不含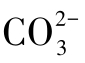 的标准碱溶液最常用的方法是:取一份纯净的NaOH,加入一份水,搅拌,使之溶解,配成50%的浓溶液。在这种浓溶液中Na2CO3的溶解度很小,待Na2CO3沉降后,吸取上层澄清液,稀释至所需浓度。稀释用的水应预先除去其中的CO2,一般将蒸馏水煮沸数分钟,冷却后使用。
的标准碱溶液最常用的方法是:取一份纯净的NaOH,加入一份水,搅拌,使之溶解,配成50%的浓溶液。在这种浓溶液中Na2CO3的溶解度很小,待Na2CO3沉降后,吸取上层澄清液,稀释至所需浓度。稀释用的水应预先除去其中的CO2,一般将蒸馏水煮沸数分钟,冷却后使用。
已配制好的NaOH溶液保存在塑料瓶中,需用橡胶塞塞紧瓶口,不可用玻璃塞。
二、NaOH溶液的标定
标定NaOH溶液的基准物质可选取草酸(H2C2O4·2H2O),苯甲酸等,但最常用的是邻苯二甲酸氢钾(KHC8H4O4,缩写KHP)。这种基准物质容易用重结晶法制得纯品,不含结晶水,不吸潮,容易保存,摩尔质量较大(204.2g/mol),由于称量而造成的误差也较小,所以它是标定碱标准溶液较好的基准物质。标定前,邻苯二甲酸氢钾应于100~125℃下干燥后备用。
标定反应式:
化学计量点时pH约为9.1,可用酚酞或百里酚酞作指示剂。
除邻苯二甲酸氢钾外,还可用草酸、苯甲酸等基准物质标定NaOH溶液。
 任务实施
任务实施
一、仪器与试剂
1. 仪器(www.daowen.com)
分析天平、台天平、称量瓶、碱式滴定管、3个锥形瓶、烧杯、量筒、玻璃棒、500mL试剂瓶。
2. 试剂
NaOH固体、基准试剂邻苯二甲酸氢钾、酚酞指示剂(0.2%乙醇溶液)。
二、操作步骤
1. NaOH溶液的配制
在台天平上称取2g固体NaOH于500mL烧杯中,加入50mL蒸馏水溶解,稀释至500mL,并转移至500mL试剂瓶中,用橡皮塞塞好瓶口,贴好标签备用。
2. NaOH溶液的标定
在分析天平上准确称取0.4~0.5g基准物质邻苯二甲酸氢钾三份,分别置于250mL的锥形瓶中,标好编号,加入30mL左右的蒸馏水使其溶解。滴加1~2滴0.2%酚酞指示剂,分别用NaOH溶液滴定至微红色,即为终点。记录每次滴定时消耗的NaOH溶液的体积(VNaOH)。
3. NaOH标准溶液浓度的计算
根据基准物质邻苯二甲酸氢钾的质量(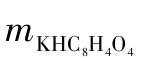 ),用下列公式计算NaOH溶液的浓度。
),用下列公式计算NaOH溶液的浓度。
三、技术提示
(1)称取NaOH固体时,应使用托盘天平或台天平,不可使用分析天平称量,并注意不要把NaOH洒在操作台上,如果洒落,应及时处理。
(2)NaOH具有强腐蚀性,不要接触到皮肤、衣服等。
(3)加热有助于邻苯二甲酸氢钾的溶解,待完全溶解并冷却至室温后,再进行标定,否则误差很大。
四、数据记录
数据记录见表3-3。
表3-3 用邻苯二甲酸氢钾(KHC8H4O4)标定NaOH溶液
五、考核标准
考核标准见表3-4。
表3-4 考核标准
续表
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







