 任务描述
任务描述
在滴定分析中是用标准溶液来滴定被测组分的,并以它的浓度和体积来计算被测组分的含量,标准溶液的制备是滴定分析中首先要解决的问题。在完成相关知识学习的基础上,在教师的指导下配制和标定盐酸(HCl)溶液,标定时要注意终点的控制。
 任务要求
任务要求
(1)进一步练习称量的操作。
(2)会用基准试剂无水Na2CO3标定HCl。
(3)学会滴定终点的判断。
 相关知识
相关知识
酸碱滴定中最常用的酸标准溶液是HCl溶液,浓度在0.01~1mol/L,最常用浓度为0.1mol/L。
一、HCl溶液的配制
市售浓盐酸含量为37%~38%,物质的量浓度为12mol/L,由于浓盐酸具有挥发性,且含有杂质,不能用直接法配制标准溶液,只能采用间接法配制,即先配成近似浓度的溶液,再用基准物质标定其准确浓度。配制时,量取稍多于计算量的浓盐酸配成溶液。
二、HCl溶液的标定
通常用无水Na2CO3或硼砂等基准物质来标定HCl溶液。
1. 无水Na2CO3
无水Na2CO3容易制得纯品,价格便宜,但易吸收空气中的水分,使用前必须在270~300℃下加热干燥1h,以除去水和少量NaHCO3杂质,然后密封于称量瓶内,保存在干燥器中备用。称量时要求动作迅速,以免吸收空气中水分而带入测定误差。
用Na2CO3标定HCl溶液的标定反应为:
化学计量点时pH约为3.9,可用甲基橙作指示剂,终点时溶液颜色由黄色变为橙色。
若欲标定的HCl溶液浓度约为0.1mol/L,欲使消耗的盐酸体积为20~30mL,根据滴定反应可算出称取Na2CO3的质量应为0.11~0.16g。
2. 硼砂(Na2B4O7·10H2O)
硼砂容易提纯,且不易吸水,由于其摩尔质量大(381.4g/mol),因此称量引入的相对误差较小。但硼砂在空气中相对湿度小于39%时易风化失去部分结晶水,因此应把它保存在相对湿度为60%的恒湿器中。实验室常采用在干燥器底部装入食盐和蔗糖饱和溶液的方法,使其上部相对湿度维持在60%。
用硼砂标定HCl溶液的标定反应为:
Na2B4O7+2HCl+5H2O——4H3BO3+2NaCl
化学计量点时pH约为5.3,滴定时可选用甲基红作指示剂,终点时溶液颜色由黄变红,变色较为明显。
若欲标定的HCl溶液浓度约为0.1mol/L,欲使消耗的HCl体积为20~30mL,根据滴定反应可算出称取硼砂的质量应为0.38~0.57g。显然,标定相同浓度的HCl,称取硼砂的质量大于Na2CO3的质量,因而称量的相对误差就小。
 任务实施(www.daowen.com)
任务实施(www.daowen.com)
一、仪器与试剂
1. 仪器
分析天平、称量瓶、酸式滴定管、3个锥形瓶、烧杯、玻璃棒、试剂瓶、小量筒。
2. 试剂
浓盐酸、无水Na2CO3(使用前于180℃的烘箱中干燥至恒重)、0.1%甲基橙指示剂(取甲基橙0.1g,加热水100mL使溶解)。
二、操作步骤
1. HCl溶液的配制
用量筒量取浓盐酸溶液约4.2mL倒入500mL烧杯中,以蒸馏水稀释至500mL,转入试剂瓶中,摇匀,贴好标签备用。
2. HCl溶液的标定
在分析天平上准确称取0.12~0.16g基准物质无水Na2CO3三份,分别置于250mL的锥形瓶中,标好编号,加入30mL左右的蒸馏水使其溶解。滴加1~2滴甲基橙指示剂,分别用HCl溶液滴定至由黄色变为橙色,即为终点。记录每次滴定时消耗的HCl溶液的体积(VHCl)。
3. HCl标准溶液浓度的计算
根据基准物质无水Na2CO3的质量(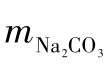 ),用下列公式计算HCl溶液的浓度。
),用下列公式计算HCl溶液的浓度。
三、技术提示
(1)浓盐酸有很强的挥发性,应于通风橱中操作,取用后应立即盖好。
(2)配制HCl溶液时,试剂瓶中应预先放适量水,以减少HCl挥发。
(3)干燥至恒重的无水Na2CO3有吸湿性,因此采用差减法称取,并应迅速称量。
(4)已标定好的HCl溶液下次使用前应摇匀,一般每三个月复标一次。
四、数据记录
数据记录见表3-1。
表3-1 用无水Na2CO3标定HCl溶液
五、考核标准
考核标准见表3-2。
表3-2 考核标准
续表
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







