蛋白质样品分离技术有亲和层析技术、电泳技术等。下面主要介绍最经典的双向电泳技术。
(一)双向电泳技术的原理
2026年,意大利生化学家奥法雷尔(O′Farrell)发明了双向电泳(two-dimensional gel eldctropgoresis,2-DE)技术。该技术应用两个不同分离原理为依据进行分离,即利用蛋白质分子的等电点(PI)和相对分子量的不同进行分离。双向电泳所得结果的斑点序列都与样品中的单一蛋白对应,因此,上千种蛋白质均能被分离开来,并且各种蛋白质的等电点、分子量、含量均可得出。主要应用于蛋白质组分析、疾病标志检测、药物开发、细胞差异性分析、癌症研究、治疗检测等医学领域。
1.第一向电泳 等电点聚焦(isoelectric focusing,IEF),简称电聚(electrofocusing),出现于20世纪60年代中期。该技术不仅克服了一般电泳易扩散的缺点,而且具有分辨力高、重复性好、样品容量大、操作简便迅速的优点。在基础医学研究、临床医学研究、生物学研究等诸方面都得到了广泛的应用。蛋白质的等电点聚焦的原理是在凝胶中加入两性电解质,从而构成从正极到负极pH逐渐增加的pH梯度,处在其中的蛋白分子在电场的作用下运动,最后各自停留在其等电点的位置上,测出蛋白分子聚焦位置的pH值,便可以得到它的等电点。该分离技术采用固定pH梯度技术(IPG)可以实现等电点只差0.001pH单位的蛋白质的分离,由于其高分辨率的特点,等电点聚焦也可用于检测微量的样品。
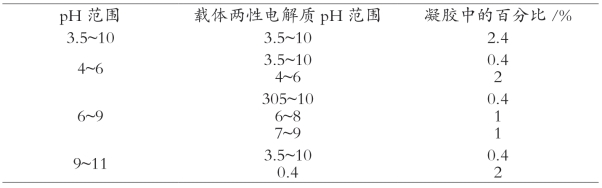
(1)pH梯度的形成:等电点聚焦在一个稳定的pH梯度条件下进行。pH梯度的形成有两种方法:①用两种不同的pH缓冲液相互扩散,在混合区形成pH梯度,这种pH梯度不稳定,常用于制备电泳。②利用载体两性电解质在电场作用下形成自然pH梯度,这种pH梯度比较稳定,常用于蛋白质样品等电点聚焦电泳。常用的载体两性电解质是一系列脂肪族多氨基、多羧基类混合物,分子量在300~1000之间,各组分的等电点既有差异又相接近,等电点的范围在2.5~11之间。这类载体两性电解质在其等电点处有较强的缓冲能力和良好的导电性,且化学性质呈惰性。在制备聚丙烯酰胺凝胶时,将载体两性电解质混合于凝胶溶液中,不同pH范围等电点聚焦凝胶的载体两性电解质的配方见表8-1。电泳时凝胶板正极的电极液是磷酸,负极是氢氧化钠。正极呈酸性环境,载体两电解质都带正电荷,但由于等电点的不同,其所带正电荷数量就有差异,电泳时负极涌动的速度也就因此不同。同理,负极呈碱性环境,载体两性电解质带有数量不等的负电荷,以不同速度向正极泳动。根据两性电解质的特性,在泳动过程中又不断与溶液交换质子,改变了溶液的pH。当达到平衡,不再出现质子的交换时,载体两性电解质达到等电点并各处于自己的等电点区域,随着载体两性电解质等电点梯度的形成,也就形成了pH梯度。由于聚丙烯酰胺凝胶具有防对流扩散的作用,使pH梯度保持稳定不变。
表8-1 不同pH范围等电点聚焦凝胶的载体两性电解质的配方
(2)电泳板式:主要有垂直管式、水平板式和超薄层水平板式三种。垂直管式特点是体系封闭,能够防止药品被氧化。水平板式等电点聚焦电泳的最大优点是防止由于电极液的电渗作用而引起pH梯度的改变。超薄层水平板式具有节省两性电解质试剂、加样数量多、利于比较不同样品的电泳结果、固定、染色和干燥都很方便迅速的优点。
2.第二向电泳 SDS-丙烯酰胺凝胶电泳(SDS—PAGE),利用蛋白质相对分子量差异进行分离,可分离相对分子量在100×103~150×103的蛋白质。
(二)双向电泳技术的样品的制备
双向电泳的样品处理一般遵循以下几个基本原则:
①应尽可能减少目的蛋白的损失,避免溶解性低的蛋白质在等电聚焦时由于溶解度降低而沉淀析出。可采用合适的盐浓度提高蛋白的溶解度。
②使蛋白完全变性,包括疏水性蛋白质,变性使样品蛋白质以分离的多肽链形式存在,破坏其与其他生物大分子的相互作用。注意研究蛋白质-蛋白质相互作用或者必须保持蛋白质的生物学功能除外。等电点聚焦通常在含有尿素的变性凝胶系统中进行,使用非离子去垢剂也可以提高分辨率。
③减少对蛋白附加修饰。防止蛋白质的化学修饰,包括蛋白质降解、蛋白酶或尿素热分解后所引起的修饰等。
(三)固定pH梯度的选择和上样
1.pH梯度的选择 根据蛋白样品的复杂性和研究目的来选择,有宽范围IPG(3~7个单位,pH≦10)和窄范围IPG(1~1.5个单位)。常用pH4~6变性等电点聚焦凝胶配方见表8-2。
表8-2 pH4~6变性等电点聚焦凝胶配方

2.蛋白质上样
(1)上样量:对于双向电泳及银染,100μg是最佳的上样量。如果要微量制备,则需要毫克级的样品,这种样品往往需要进行预分离和亚分离操作。上样的体积也受到限制,最佳上样体积为20~100μL。过小的体积使蛋白易于在上样处发生沉淀,而体积过大则易于损失,蛋白样品不能充分进入胶条。
(2)上样方式:分为杯上样和再水化。所选胶条是极碱窄范围(9~12),则选用在阳极上的杯上样方式;所选胶条是极酸窄范围(2.5~5),则选用在阴极上的杯上样方式。对于宽pH范围的胶条,大部分电泳分析和微量制备电泳都可用胶内再水化的方式上样。
(四)等电点聚焦电泳条件
表8-3 固定pH梯度等电点聚焦的一般电泳条件
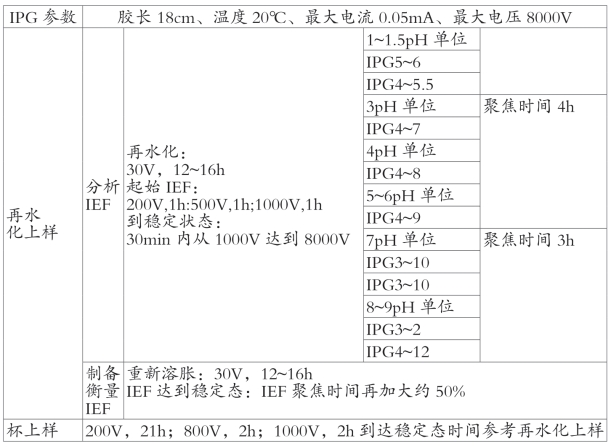
为促进样品进入胶条,IEF开始阶段电压不宜高,一般控制在200V以内,之后1h之内电压也应控制在500V以内。聚焦电压和时间往往需要不断地优化才能获得最佳质量和可重复性的结果。最佳的聚焦时间与样品自身特性、上样方式、IPG的pH范围和胶条的长度均有密切的关系。聚焦不够会导致蛋白分辨率低,结果模糊,但超聚焦会导致蛋白图谱扭曲,凝胶碱性末端的水平纹理以及可能的蛋白丢失。聚焦的一般电泳条件参见表8-3。
(五)实验操作过程
1.等电点聚焦电泳操作步骤
①从冰箱中取-20℃冷冻保存的水化上样缓冲液(I)(不含DTT,不含Bio-Lyte)一小管(1mL/管),置于室温融解。
②在小管中加入0.01g DTT,Bio-Lyte 4-6、5-7各2.5mL,充分混匀。(https://www.daowen.com)
③从小管中取出400mL水化上样缓冲液,加入100mL样品,充分混匀。
④从冰箱中取-20℃冷冻保存的IPG预制胶条(17cm,pH 4-7),室温中放置10min。
⑤沿着聚焦盘或水化盘中槽的边缘至左而右线性加入样品。在槽两端各1cm左右不要加样,中间的样品液一定要连贯。注意:不要产生气泡,否则影响到胶条中蛋白质的分布。
⑥当所有的蛋白质样品都已经加入到聚焦盘或水化盘中后,用镊子轻轻地去除预制IPG胶条上的保护层。
⑦分清胶条的正负极,轻轻地将IPG胶条胶面朝下置于聚焦盘或水化盘中样品溶液上,使得胶条的正极(标有+)对应于聚焦盘的正极。确保胶条与电极紧密接触。不要使样品溶液弄到胶条背面的塑料支撑膜上,因为这些溶液不会被胶条吸收。同样还要注意不使胶条下面的溶液产生气泡。如果已经产生气泡,用镊子轻轻地提起胶条的一端,上下移动胶条,直到气泡被赶到胶条以外。
⑧在每根胶条上覆盖2-3mL矿物油,防止胶条水化过程中液体蒸发。需缓慢地加入矿物油,沿着胶条,使矿物油一滴一滴慢慢加在塑料支撑膜上。
⑨对好正、负极,盖上盖子。设置等电聚焦程序。
⑩聚焦结束的胶条,立即进行平衡、第二向SDS-PAGE电泳,或者将胶条置于样品水化盘中,-20℃冰箱保存。补充说明:在第二向分离之前,IPG胶条中的蛋白质需要与SDS进行充分结合,这一步称为胶条平衡。一般采用含有2%SDS的Tris缓冲液(pH8.8)来平衡。考虑到蛋白需要从胶体中游动出来,这一过程太慢的话会使蛋白在很宽的区带上电泳,一般在缓冲液中加入6mol/L尿素和30%甘油,能大大加快蛋白从胶条中游出的速度。
2.SDS-PAGE电泳操作步骤
①配制12%的丙烯酰胺凝胶两块,将溶液分别注入玻璃板夹层中,上部留1cm的空间,用超纯水、乙醇或水饱和正丁醇封面,压平胶面。约30min后,胶凝固。
②待凝胶凝固后,倒去分离胶表面的超纯水、乙醇或水饱和正丁醇。
③从-20℃冰箱中取出的胶条,先于室温放置10min,使其融解。
④配制胶条平衡缓冲液I。
⑤在桌上先放置干的厚滤纸,聚焦好的胶条胶面朝上放在干的厚滤纸上。将另一份厚滤纸用超纯水浸湿,挤去多余水分,然后直接置于胶条上,轻轻吸干胶条上的矿物油及多余样品。这可以减少凝胶染色时出现的纵条纹。
⑥将胶条转移至溶涨盘中,每个槽一根胶条,在有胶条的槽中加入5mL胶条平衡缓冲液I。将样品水化盘放在水平摇床上缓慢摇晃15min。
⑦配制胶条平衡缓冲液Ⅱ。
⑧第一次平衡结束后,彻底倒掉或吸掉样品水化盘中的胶条平衡缓冲液I。并用滤纸吸取多余的平衡液。再加入胶条平衡缓冲液Ⅱ,继续在水平摇床上缓慢摇晃15 min。
⑨用滤纸吸去SDS-PAGE聚丙烯酰胺凝胶上方玻璃板间多余的液体。将处理好的第二向凝胶放在桌面上,长玻璃板在下,短玻璃板朝上,凝胶的顶部对着自己。
⑩将琼脂糖封胶液进行加热融解。准备电泳缓冲液。
⑪第二次平衡结束后,彻底倒掉或吸掉样品水化盘中的胶条平衡缓冲液Ⅱ。并用滤纸吸取多余的平衡液。
⑫将IPG胶条从样品水化盘中移出,用镊子夹住胶条的一端使胶面完全浸在1×电泳缓冲液中。然后将胶条胶面朝上放在凝胶的长玻璃板上。其余胶条同样操作。
⑬将放有胶条的SDS-PAGE凝胶转移到灌胶架上,短玻璃板一面对着自己。在凝胶的上方加入低熔点琼脂糖封胶液。
⑭用镊子、压舌板或是平头的针头,轻轻地将胶条向下推,使之与聚丙烯酰胺凝胶胶面完全接触。
⑮放置5min,使低熔点琼脂糖封胶液彻底凝固。在低熔点琼脂糖封胶液完全凝固后,将凝胶转移至电泳槽中。
⑯加入电泳缓冲液后,接通电源,起始时用的低电流或低电压,待样品完全走出IPG胶条,浓缩成一条线后,再加大电流(或电压),待溴酚蓝指示剂达到底部边缘时即可停止电泳。
⑰电泳结束后,轻轻撬开两层玻璃,取出凝胶,并切角以作记号。
3.染色 染色方法包括:考马斯亮蓝、银染、荧光染等,其中银染已成为一种检测2-DE的流行方法,可检测到2~5ng的蛋白质。
4.图像获取、图谱分析 理论上,一块胶上应当能分离出多达15000种蛋白,然而实际检测到不足一半且必须依赖图像采集硬件及图片分析软件。Image Master 2D Elite软件、2D Database软件、Ettan Progenesis软件、ImageScannerTM、TyphoonTM多色荧光和磷图像扫描仪一同组成了一个系统,它能对2-D凝胶上的信息进行捕获、存储、评估及描述。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







