DNA插入片段和质粒DNA在体外连接形成重组质粒,即带有外源DNA片段的重组体分子在体外构成之后,需要被导入到细胞内才能进行扩增和表达,并获得大量的纯一的重组体DNA分子。这样一种过程习惯上叫做基因的扩增(amplification)。接受重组DNA分子的细胞称作受体细胞或宿主细胞。选定的宿主细胞必须具备使外源DNA进行复制的能力,而且还应该能够表达由导入的重组体分子所提供的某种表型特征,这样才有利于转化子细胞的选择与鉴定。受体细胞分为原核细胞(如大肠杆菌)和真核细胞(如酵母、哺乳动物细胞及昆虫细胞)。原核细胞既可作为基因复制扩增的场所,也可作为基因表达的场所;真核细胞一般用作基因表达系统。
将外源重组体分子导入受体细胞的途径,包括转化、转染、显微注射和电穿孔等多种不同的方式。一般将重组DNA分子导入原核细胞的过程称为转化(transformation),而将重组DNA分子导入真核细胞的过程称为转染(transfection)。转化和转染主要适用于细菌一类的原核细胞和酵母这样的低等真核细胞,而显微注射和电穿孔则主要应用于高等动植物的真核细胞。在本章所讨论的用于接受重组体DNA导入的宿主细胞,只限于大肠杆菌。因为在所有的关于重组DNA的研究工作中,都使用了大肠杆菌K12突变体菌株。该菌株由于丧失了限制体系,故不会使导入细胞内的未经修饰的外源DNA发生降解作用。对于大肠杆菌宿主,无论是转化还是转导,都是十分有效的导入外源DNA的手段。当然,除了大肠杆菌之外,其他的一些细菌,例如枯草芽孢杆菌(B.subtilis),也已经发展成为基因克隆的宿主菌株。
受体细胞是重组基因增殖的场所,对受体细胞也应具有几个要求:①容易接纳重组DNA分子;②对载体的复制扩增无严格限制;③不存在特异的内切酶体系降解外源DNA;④不对外源DNA进行修饰;⑤有限制修饰系统、感染寄生和重组基因缺陷,外源DNA可存活,且不发生重组;⑥具有一个可供遗传标记检测的遗传背景。由于载体的不同,所具备的筛选标志不同,所用的受体细胞也不同,因此可根据所用的载体选择合适的受体细胞。
未经处理的大肠杆菌很难受纳重组DNA分子,但将大肠杆菌用物理或化学方法处理后,细胞对摄取外来DNA分子变得敏感了,这种经过处理而容易接受外源DNA分子的细胞叫做感受态细胞(competent cell)。在分子克隆中,感受态细胞转化效率的高低是限制克隆成功率的一个重要因素。在基因操作中,转化一词,严格地说是指感受态的大肠杆菌细胞捕获和表达质粒载体DNA分子的生命过程(见图5-20)。而转染一词(transfection),则是专指感受态的大肠杆菌细胞捕获和表达噬菌体DNA分子的生命过程。但从本质上讲,两者并没有什么根本的差别。无论转化还是转染,其关键的因素都是用氯化钙处理大肠杆菌细胞,以提高膜的通透性,从而使外源DNA分子能够容易地进入细胞内部(见图5-20)。所以习惯上,人们往往也通称转染为广义的转化。
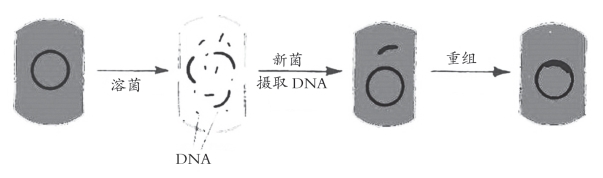
图5-20 转化过程
将重组DNA分子和感受态大肠杆菌细胞相混合,使DNA分子进入大肠杆菌细胞中,实现了重组DNA分子的转化。用质粒作为载体的重组DNA分子可以通过转化引进细胞。用λ噬菌体的DNA作载体的重组分子直接经转染引入细胞的效率较低;一般需先行离体包装,即把重组DNA分子包在噬菌体外壳中,再通过噬菌体感染把重组DNA分子引入敏感细菌细胞中。它的效率比转染高出几十到几百倍。细菌转化(或转染)的具体操作程序是:例如用氯化钙制备新鲜的大肠杆菌感受态细胞的简单方案是Cohen等(1972)所用方法的变通方案,常用于成批制备感受态细菌,该方案的转化效率足以满足所有在质粒中进行的常规克隆的需要。该方法完全适用于大多数大肠杆菌菌株。该法制备的感受态细胞可贮存于-70℃,但保存时间过长会使转化效率在一定程度上受到影响。具体过程如下:
①从于37℃培养16~20h的新鲜平板中挑取一个单菌落(直径2~3mm),转到一个含有100m1 LB培养基的1L烧瓶中。于37℃剧烈振摇培养约3h(旋转摇床,300转/分)。为得到有效转化,活细胞数不应超过108个细胞/m1,可每隔20~30min测量OD600值来监测培养物的生长情况。
②在无菌条件下将细菌转移到一个无菌、一次性使用的、用冰预冷的50m1离心管中,在冰上放置10min,使培养物冷却至0℃。(切记:下述所有步骤均需无菌操作)
③于4℃,以4000转/分离心10min,以回收细胞。
④倒出培养液,将管倒置1min以使最后残留的痕量培养液流尽。
⑤以10mL用冰预冷的0.1mol/L CaCl2重悬每份沉淀,放置于冰浴上。
⑥于4℃,以4000转/分离心10min,以回收细胞。(www.daowen.com)
⑦倒出培养液,将管倒置1min以使最后残留的痕量培养液流尽。
⑧每50mL初始培养物用2m1用冰预冷的0.1mol/L CaCl2重悬每份细胞沉淀。此时,可将细胞分装成小份,放于-70℃冻存。在这些条件下,尽管长期保存后转化效率会稍有下降,但细胞仍可保持处于感受态。于4℃在CaCl2溶液中保存24~48h,在贮存的最初12~24h内,转化效率增加3~5倍,然后降低到初始水平。
⑨用冷却的无菌吸头从每种感受态细胞悬液中各取200μL转移到无菌的微量离心管中,每管加DNA(体积<10μL,DNA<50ng),轻轻旋转以混匀内容物,在冰中放置30min。实验中一定要包括下面的对照:①加入已知量的标准超螺旋质粒DNA制品的感受态细胞。②完全不加质粒DNA的感受态细菌。
⑩将管放到预加温到42℃的循环水浴中的试管架上,放置90秒,不要摇动试管。
⑪快速将管转移到冰浴中,使细胞冷却1~2min。
⑫每管加800μL LB培养基。用水浴将培养基加温至37℃,然后将管转移到37℃摇床上,温浴45min使细菌复苏,并且表达质粒编码的抗生素抗性标记基因。如果要求更高的转化效率,在复苏期,应温和地摇动细胞(转速不超过225转/分)。
⑬将100μL已转化的感受态细胞转移到含相应抗生素的LB琼脂培养基上。用一无菌的弯头玻棒轻轻地将转化的细胞涂到琼脂平板表面。
⑭将平板置于室温直至液体被吸收。
⑮倒置平皿,于37℃培养,12~16h后可出现菌落。观察平板上长出的菌落克隆,以菌落之间能互相分开为好。
目前制备各种细菌感受态的最常用方法是CaCl2法,转化效率一般为106~107个转化子/g DNA,是一般的克隆实验中最常用的简便而重复性好的方法。目前已有商品化的细菌感受态细胞出售,但价格较为昂贵。
细菌转化的另一种方法是电穿孔(elctroporation)法。电穿孔法的转化效率可达109-1010个转化子/g DNA。电穿孔转化技术中与转化效率有关的主要参数是电压、电容、阻抗和脉冲时间等。这些参数因菌种和介质不同而异,已有不少较成熟的条件供参考。酵母细胞的转化多采用电穿孔法。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




