(一)DNA的变性(denaturation)
DNA分子是由两条反向平行的脱氧多核苷酸链所组成,其中一条链的碱基与另一条的碱基之间以氢键连接,并以A-T,G-C互补,整个DNA分子呈双螺旋结构。在某些理化因素作用下,链间氢键断裂,形成两条单链结构,这种现象称为DNA变性。
DNA在溶液中发生变性伴随着一系列的物理化学性质的改变,如紫外吸收强度的增加,此种现象称为增色效应(hyperchromicity);溶液黏度的降低;沉降速度增加等。这些物理常数常用来研究各种DNA结构和功能。对某一DNA来说,其紫外吸收强度(A260)是双链DNA单链DNA,紫外吸收强度的增加与变性(解链)程度成正比。若将A260的增加与温度的关系作图,可得解链曲线(图4-1)。DNA的热变性常称为DNA的“融解”(melting),解链曲线的中点所示温度称为Tm或称为融点,Tm表示使50%DNA分子解链的温度。不同种类DNA有不同的解链曲线,也有不同的Tm,Tm随G+C百分含量呈线性增加(图4-2)。每增加1%G+C含量,Tm增加约0.4℃,这是由于G/C碱基对之间的氢键多于A/T对之故。溶液的离子强度对Tm有较大的影响,单价阳离子浓度每增加10倍,Tm增加16.6℃。某些化学试剂能显著影响Tm值,例如甲酰胺能破坏氢键,使Tm大大降低。
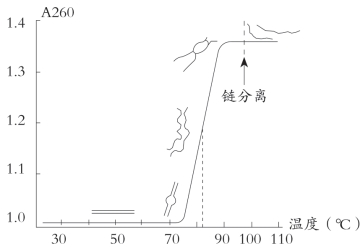
图4-1 DNA变性过程和变性曲线
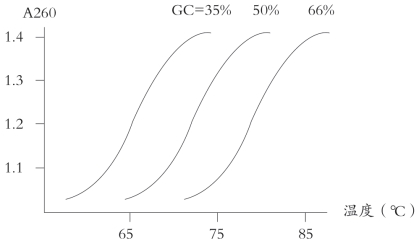
图4-2 G+C含量对变性的影响
DNA变性有两个阶段,第一阶段部分解链,已解开部分不规则卷曲;第二阶段为完全解开,形成两条单链,此时若迅速泠却,每条链自身卷曲,部分区域形成链内双螺旋。第一阶段变形可以逆转,即当温度降低时,已解开的链又会重新盘绕,形成完整的天然双螺旋。第二阶段DNA双链完全分开,很难恢复到天然构型。
轻度变性,往往只有A-T分开,G-C不分开,富含A-T的区域就形成小“泡”,富含G-C区域保持双链结构,在电镜中可以观察到这种结构,从而推测DNA的结构特征(图4-3)。
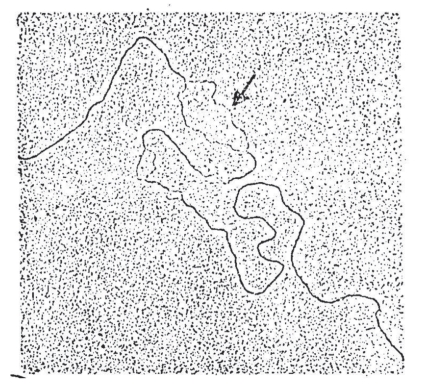
图4-3 电子显微镜下的DNA分子的部分变性
已变性的DNA,若两条单链碱基组成不同,嘌呤比例高低不一,分子量和分子密度也就不同,所以可以用密度梯度离心或电泳法将变性后形成的两条单链分离开来。
(二)DNA复性(renaturation)
在去除变性因素时,两条变性的碱基互补的单链DNA可以恢复成双链结构,恢复原有的物理化学特性和生物学活性,这种现象称为DNA复性,或称为退火(annealing)。影响变性与复性过程的主要因素是温度、DNA浓度、复性时间和盐浓度、变性剂浓度。一般来说,DNA浓度愈高,复性愈快,因为在一定时间里,互补的单链DNA发生碰撞的几率愈高。时间愈长,发生复性愈多。高盐浓度易于复性,有变性剂存在,不易复性。
解离的核酸互补链,重新形成碱基配对的螺旋结构的复性速度取决于下列四个参数:
1.正离子浓度 离子作为反离子减少两条互补链的磷酸基团的负电荷排斥力,一般复性反应都采用0.18mol/L Na+浓度。
2.反应温度 复性反应都需要在一定的温度下进行,用以破坏和弱化链内的二级结构。一般复性温度都采用低于该DNA Tm 25℃的温度,即60~65℃左右。
3.DNA浓度 DNA复性反应服从于二级反应动力学,所以DNA浓度决定分子间的碰撞频率,影响复性反应的速度。
4.DNA片段大小 DNA片段越大,扩散速度越低,使DNA片段线状单链互相发现、互补的机会减少。因此在复性试验中,有时将DNA切成小片段,再进行复性。
(三)分子杂交(molecular hybridization)
指具有一定同源序列的两条核酸单链(DNA或RNA),在一定条件下按碱基互补配对原则经过退火处理,形成异质双链的过程。
利用这一原理,就可以使用已知序列的单链核酸片段作为探针,去查找各种不同来源的基因组DNA分子中的同源基因或同源序列。
1.核酸探针
(1)探针的概念:放射性同位素、生物素或荧光染料进行标记的已知序列的核酸片段,即为探针(probe)。探针可用于分子杂交,杂交后通过放射自显影、荧光检测或显色技术,使杂交区带显现出来。
(2)探针的种类及其选择:基因探针根据标记物不同可粗分为放射性探针和非放射性探针两大类;根据探针的来源及核酸性质不同又可分为DNA探针、RNA探针、cDNA探针及寡核苷酸探针等几类。
1)DNA探针:DNA探针是最常用的核酸探针,指长度在几百碱基对以上的双链DNA或单链DNA探针。现已获得的DNA探针数量很多,有细菌、病毒、原虫、真菌、动物和人类细胞DNA探针。探针多为某一基因的全部或部分序列,或某一非编码序列。
DNA探针(包括cDNA探针)的优点:
①这类探针多克隆在质粒载体中,可以无限繁殖,取之不尽,制备方法简便。
②不易降解(相对RNA而言),一般能有效抑制DNA酶活性。
③DNA探针的标记方法较成熟,有多种方法可供选择,如缺口平移,随机引物法等,能用于同位素和非同位素标记。
2)cDNA探针:cDNA(complementary DNA)探针是指互补于mRNA的DNA分子,是由逆转录酶催化合成的。该酶以RNA为模板,根据碱基配对原则,按照RNA的核苷酸顺序合成DNA(其中U与A配对)。cDNA探针是目前应用最为广泛的一种探针。
3)RNA探针:RNA探针是一类很有前途的核酸探针,由于RNA是单链分子,所以它与靶序列的杂交反应效率极高。早期采用的RNA探针是细胞mRNA探针和病毒RNA探针,这些RNA是在细胞基因转录或病毒复制过程中得到标记的,标记效率往往不高,且受到多种因素的制约。这类RNA探针主要用于研究目的,而不是用于检测。
前述三种探针均是可克隆的,一般情况下,只要有克隆的探针,就不用寡核苷酸探针。在DNA序列未知而必须首先进行克隆以便绘制酶谱和测序时,也常应用克隆。
克隆探针的优点:①特异性强,从统计学角度而言,较长的序列复杂度高,随机碰撞互补序列的机会较短序列少。②可获得较强的杂交信号,因为克隆探针较寡核苷酸探针掺入的可检测标记基团更多。
4)寡核苷酸探针:根据已知的核酸序列,采用DNA合成仪合成一定长度的寡核苷酸片段,亦可作为探针使用。若不知核酸序列,可根据蛋白质的氨基酸顺序推导出核酸顺序,但要考虑到密码子的兼并性。多用于克隆筛选和点突变分析。
人工合成的寡核苷酸探针有下述优点:
①短的探针比长探针杂交速度快,特异性强。
②可以在短时间内大量制备。
③在合成中进行标记制成探针。
④可合成单链探针,避免了双链DNA探针在杂交中的自我复性,提高杂交效率。
⑤寡核苷酸探针可以检测小DNA片段,在严格的杂交条件下,可用于检测在序列中单碱基对的错配。
筛选寡核苷酸探针的原则:
①长18~50bp,较长探针杂交时间较长,合成量低;较短探针特异性会差些。
②碱基成分:G+C含量为40%~60%,超出此范围则会增加非特异杂交。
③探针分子内不应存在互补区,否则会出现抑制探针杂交的“发夹”结构。
④避免单一碱基重复出现(不能多于4个),如—CCCCC—。(https://www.daowen.com)
⑤一旦选定某一序列符合上述标准,最好将序列与核酸库中的核酸序列比较,探针序列应与含靶序列的核酸杂交,而与非靶区域的同源性不能超过70%或有连续8个或更多的碱基同源,否则该探针不能用。
2.标记物 目前基因检测方法中以同位素标记(32P、35S等)DNA探针灵敏度最高,但由于放射性污染、半衰期短、需要特别的安全防护条件等,限制了同位素标记探针的广泛应用。因此,非同位素标记探针的研制引起了重视。
(1)放射性核素:核酸探针传统的标记物是用放射性同位素,常用的有:32P dNTP、3H dNTP、35S dNTP。
1)放射性同位素标记核酸的优点
①灵敏性高:一般可达到0.5~5pg或更低浓度核酸的检测水平,可以检测极少量或拷贝数少的基因组。
②特异性高:用放射自显影法,样品中存在的无关核酸或非核酸成分不会干扰检测结果,准确率高,假阳性率低。
③方法简便。
2)放射性同位素标记技术的缺点
①半衰期短,必须经常标记探针:如32P半衰期只有14.3天,放射强度逐日变化。35S的半衰期可达88天,但衰变能量只有32P的1/10,灵敏度较低,只能用于多拷贝基因的检测。3H的半衰期虽长达12.26年,但衰变能低,灵敏度太低。
②费用高:α-32P标记的dATP(400Ci/mmol),需要进口试剂,价格高。
③检测时间长:用放射自显影需要较长的曝光时间(1~15天)。
④其他:放射性同位素对人体有害,实验室和环境易被污染,放射性废物处理困难。因此,推广使用受到限制。
(2)非放射性标记物
1)优点:①无放射性污染;②稳定性好;③探针可长时间保存。
2)缺点:灵敏度及特异性不高。
3)非放射性标记物的种类
①半抗原:生物素、地高辛,利用半抗原的抗体进行免疫学检测。
②配体:生物素还是一种抗生物素蛋白avidin和链亲和素streptavidin的配体。
③荧光素:异硫氰酸荧光素和罗丹明,可被紫外线激发出荧光而被检测到。
④光密度或电子密度标记物:金、银。
4)生物素标记:生物素标记的核苷酸是最广泛使用的一种,如生物素-11-dUTP,可用缺口平移或末端加尾标记法。实验发现生物素可共价连接在嘧啶环的5位上,合成TTP或UTP的类似物。
5)地高辛标记探针:地高辛(Digoxigenin)又称异羟基洋地黄毒苷,这种类固醇半抗原仅限于洋地黄类植物,其抗体与其他任何固醇类似物如人体中的性激素等无交叉反应。先将地高辛连接至dUTP上,生成地高辛配基(Dig-dUTP),再用随机引物法将地高辛配基掺入DNA制成探针。然后用抗地高辛抗体与碱性磷酸酶的复合物和NBT-BCIP底物显色检测,灵敏度达0.1pg DNA。此种探针有高度的灵敏性和特异性,安全稳定,操作简便,可避免内源性干扰,是一种很有推广价值的非放射性标记探针。
3.核酸杂交方法 核酸分子杂交可按作用环境大致分为液相杂交和固相杂交两种类型。
(1)固相杂交:固相杂交是将参加反应的一条核酸链先固定在固体支持物上,另一条核酸链游离在溶液中。由于固相杂交后,未杂交的游离片段可容易地漂洗除去,膜上留下的杂交物容易检测和能防止靶DNA自我复性等优点,故该法最为常用。
常用的固相杂交类型有:菌落原位杂交、斑点杂交、狭缝杂交、Southern印迹杂交、Northern印迹杂交、组织原位杂交和夹心杂交等。
(2)液相杂交:液相杂交是指待测核酸和探针都存在于杂交液中,探针与待测核酸在液体环境中按照碱基互补配对形成杂交分子的过程。液相杂交是研究最早的杂交类型,但应用的普遍程度较固相杂交低。
液相杂交的特点:无需支持物。待测核酸分子不用固定在支持物上。其弊端是由于杂交后过量的未杂交探针存在于溶液中,在已有杂交结合物检测水平条件下检测误差较高。故液相杂交在过去较少应用。近年来由于杂交检测技术不断进步,商业检测试剂盒的开发等,液相杂交技术得到了迅速发展。
常用的液相杂交类型有:吸附杂交、发光液相杂交、液相夹心杂交、复性速率液相分子杂交等。
(3)影响杂交灵敏度的因素
1)时间与杂交灵敏度:核酸杂交一般采用杂交过夜12h以上。但有实验结果表明,杂交反应在6h之内就已完成,再延长反应时间,灵敏度也不再提高。文献报道用生物素标记探针进行杂交,1~2h内可出现杂交信号,但也有文献报道,尽管在4h内可出现杂交信号,但其灵敏度未达最高,与6h杂交结果相差1个数量级。
2)温度与杂交灵敏度:温度是杂交反应中重要的因素,一般采用比Tm值低25℃的温度,常用温度为24~68℃。温度升高或降低均会使灵敏度下降。
3)探针浓度与杂交灵敏度:一般来说,杂交灵敏度随探针浓度的增加而增加,但若探针浓度太高,非特异信号也会增强,随着探针浓度逐渐提高,灵敏度的增加幅度逐渐减小。
4)甲酰胺浓度与灵敏度:理论上甲酰胺可降低核酸的Tm值,使氢键易于打断,每加入1%的甲酰胺可使Tm值降低0.72℃。
核酸杂交反应是多因素、多水平的反应体系,各因素各水平之间存在交互影响。
(4)杂交信号检测
1)放射自显影:利用放射线在X线片上的成影作用来检测杂交信号,称为放射自显影。
2)非放射性核素探针的检测:
偶联反应:
①半抗原——通过抗原-抗体反应与显色体系偶联。
②配体——亲和法与显色体系偶联:生物素-抗生物素蛋白-酶(Avidin-Biotin-Enzyme-Complex,ABC)。
显色反应:通过连接抗体或生物素蛋白的显色物质如酶、荧光素等进行杂交信号的检测。
①酶学检测:是最常用的检测方法,通过酶促反应使底物形成有色产物。最常用的酶是辣根过氧化物酶和碱性磷酸酶,也有使用酸性磷酸酶和β-半乳糖苷酶。
②荧光检测:常用的有异硫氰酸荧光素(FITC)和罗丹明,可被紫外线激发出荧光而被检测到。主要应用于原位杂交。
③化学发光法:是指在化学反应过程中伴随的发光反应。目前常用的是辣根过氧化物酶(HRP)催化鲁米诺(luminol)伴随的发光反应。适合于Southern、Northern及斑点杂交。
④电子密度标记:利用重金属的高电子密度,在电子显微镜下进行检测,适合于细胞原位杂交。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






