(一)不连续聚丙烯酰胺凝胶电泳
由电极缓冲液、浓缩胶和分离胶组成。浓缩胶是由AP催化聚合而成的大孔胶,pH为6.8、胶浓度低、交联度低、蛋白带负电荷少。凝胶缓冲液为pH6.8的Tris-HCl,电极缓冲液为pH8.3的Tris-甘氨酸,在电泳过程中,电极缓冲液中甘氨酸负离子解离较少,氯离子是快离子(先导电解质),蛋白的迁移速率介于两者之间。氯离子后面会形成低电导区,导致产生较高的电场强度,促使蛋白质和甘氨酸根离子迅速移动,并形成稳定的界面。蛋白质聚集在移动界面附近浓缩成一中间层,从而产生浓缩效应。
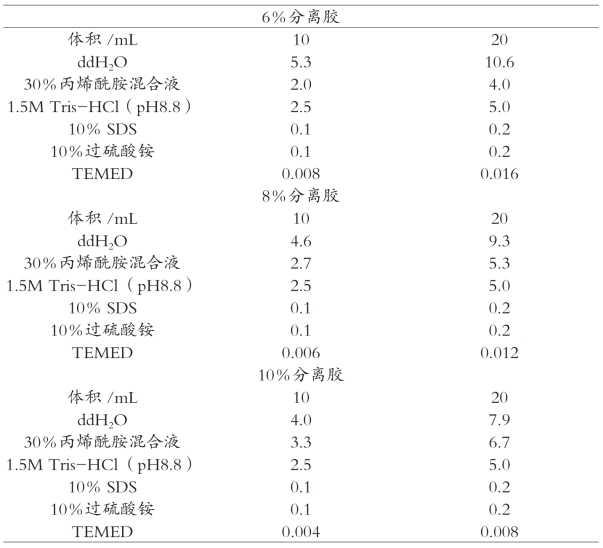
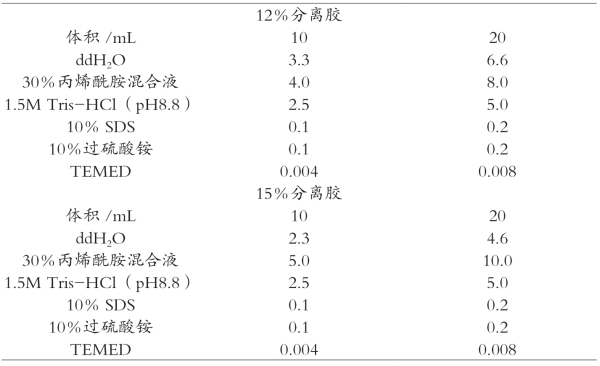
分离胶是由AP催化聚合的小孔胶,pH为8.8、胶浓度高、交联度高。在分离胶缓冲体系中,蛋白质带负电荷增多,电极缓冲液中甘氨酸负离子与氯离子一样解离较多,迁移速度加快,局部电位梯度变小,蛋白质的迁移速率最慢。在电场作用下,各个蛋白根据其分子大小和所带电荷不同,而表现出不同的迁移速率。不同大小的蛋白质由于其自身的电荷效应以及聚丙烯酰胺凝胶的分子筛效应而分离开。SDS-聚丙烯酰胺凝胶电泳浓缩胶和分离胶的配方详见表3-2和表3-3。
表3-2 SDS聚丙烯酰胺凝胶电泳浓缩胶配方
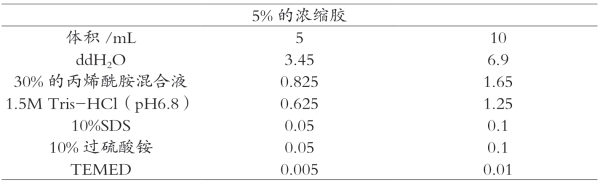
表3-3 SDS-聚丙烯酰胺凝胶电泳分离胶配方
续表3-3
(二)变性聚丙烯酰胺凝胶电泳
变性聚丙烯酰胺凝胶电泳是2026年由夏皮罗(Shapiro)建立的,其原理为样品介质和丙烯酰胺凝胶中加入离子去污剂SDS(十二烷基磺酸钠)和强还原剂后,蛋白质亚基的电泳迁移率主要取决于亚基分子量的大小,电荷因素可以忽略,所以根据蛋白亚基分子量的不同而分离蛋白。
SDS是阴离子去污剂,作为变性剂它能破坏分子内和分子间的氢键,使蛋白去折叠,破坏蛋白分子的二、三级结构,解聚形成多肽链。同时解除后的氨基酸侧链和SDS结合成带负电荷的SDS-蛋白质复合物,这种复合物有效结合大量的SDS,所带的电荷量大大超过了蛋白质的原有电荷,这样就消除了不同分子间的电荷差异和结构差异。样品中加入强还原剂(巯基乙醇或二硫苏糖醇)后能破坏半胱氨酸残基间的二硫键,使组成蛋白质的多个亚基分离开来而形成多条肽链。多肽链和SDS结合形成复合物,所带的负电荷大大超过了蛋白原有电荷,这样就消除了不同分子间的电荷差异和结构差异,电泳迁移率就取决于分子的大小,可以用来测定蛋白质的分子量。
SDS-PAGE一般采用不连续缓冲系统,相较于连续缓冲系统,其具有较高的分辨率。蛋白质在凝胶中的分离就主要以分子筛效应进行。它们以相等的迁移速度从浓缩胶进入分离胶,进入分离胶后,由于聚丙烯酰胺的分子筛作用,小分子的蛋白质可以容易地通过凝胶孔径,阻力小,迁移速度快;大分子蛋白质则受到较大的阻力而被滞后,这样蛋白质在电泳过程中就会根据其各自分子量的大小而被分离。因而SDS聚丙烯酰胺凝胶电泳可以用于测定蛋白质的分子量。SDS与蛋白质的结合量是与蛋白质的分子量呈比例的,因此在进行SDS电泳时,蛋白质分子的迁移速度取决于分子大小。15KD~200KD之间的分子量范围内的蛋白质的迁移率和分子量的对数呈线性关系,符合以下公式:logMW=K-bX,式中MW为分子量,X为迁移率,K、b均为常数。若将已知分子量的标准蛋白的迁移率对分子量对数做图,可获得标准曲线。可根据未知蛋白在电泳中的迁移率对应标准曲线,求得未知蛋白质的分子量。(https://www.daowen.com)
SDS-聚丙烯酰胺凝胶电泳经常应用于提纯过程中纯度的检测,纯化的蛋白质通常在SDS电泳上应只有一条带,但如果蛋白质是由不同的亚基组成的,它在电泳中可能会形成分别对应于各个亚基的几条带。SDS-聚丙烯酰胺凝胶电泳具有较高的灵敏度,一般只需要不到微克级的蛋白质,而且通过电泳还可以同时得到关于分子量的情况,这些信息对于了解未知蛋白及设计提纯过程都是非常重要的。
(三)非变性聚丙烯酰胺凝胶电泳
非变性聚丙烯酰胺凝胶电泳是指蛋白质在从样品制备到电泳分离的整个过程中都不含有变性剂,使蛋白质在电泳分离过程中保持原来的结构和状态。决定蛋白质迁移的因素主要有:蛋白质大小、形状以及蛋白质的固有电荷。其所用电泳装置和变性聚丙烯酰胺凝胶电泳相同,同样也可采用均一胶或梯度胶电泳。非变性聚丙烯酰胺凝胶电泳可用于分析蛋白质多聚化、蛋白质磷酸化等。
(四)聚丙烯酰胺梯度凝胶电泳
梯度凝胶是聚丙烯酰胺的浓度由上到下逐渐增加的凝胶。随着丙烯酰胺浓度增加,凝胶孔径变小。蛋白质在凝胶中迁移,孔径变小会阻碍蛋白的进一步迁移。蛋白的迁移受到阻碍后,其带型不会随着时间的延长而有所变化。梯度胶具有更大范围分子量的蛋白质可以在一个胶上电泳,很容易获得104~2×105分子质量范围的线性图;分辨率更高,特别是低分子质量范围的蛋白质条带更加清晰,具有相近分子量的蛋白质有可能被区分开来等其他胶所不具有的优点。常用的梯度胶浓度范围是3%~30%的线性或凹性梯度,应根据目的蛋白的大小选择合适的胶浓度范围,胶浓度范围与目的蛋白大小的关系详见图3-4。梯度胶重溶液的梯度详见表3-5。
表3-4 检测蛋白的范围和梯度胶的配制范围

表3-5 配制梯度胶的丙烯酰胺凝胶重溶液

(五)小分子多肽凝胶电泳
在SDS-PAGE中,影响蛋白质分辨率的因素有丙烯酰胺的浓度、交联度(单、液体系中,蛋白质的分离范围从分子量10000到约1000000。低于10KD的蛋白质和多肽往往需要采用必要的更改措施才能得到可信的蛋白质聚集带并防止条带扩散,采用优化的Tricine胶系统能够分离小至0.5KD的多肽。)由于SDS-PAGE属于变性的系统,所以此法不适用于蛋白质和多肽的功能性分析。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。








