
(一)PCR的基本构成
PCR基本原理是以单链DNA为模板,4种dNTP为底物,在模板3′末端有引物存在的情况下,用酶进行互补链的延伸,多次反复的循环能使微量的模板DNA得到极大程度的扩增。在微量离心管中,加入与待扩增的DNA片段两端已知序列分别互补的两个引物、适量的缓冲液、微量的DNA模板、四种dNTP溶液、耐热Taq DNA聚合酶、Mg2+等。反应时先将上述溶液加热,使模板DNA在高温下变性,双链解开为单链状态;然后降低溶液温度,使合成引物在低温下与其靶序列配对,形成部分双链,称为退火;再将温度升至合适温度,在Taq DNA聚合酶的催化下,以dNTP为原料,引物沿5′→3′方向延伸,形成新的DNA片段,该片段又可作为下一轮反应的模板,如此重复改变温度,由高温变性、低温复性和适温延伸组成一个周期,反复循环,使目的基因得以迅速扩增。因此PCR循环过程为三部分构成:模板变性、引物退火、热稳定DNA聚合酶在适当温度下催化DNA链延伸合成(图2-1)。
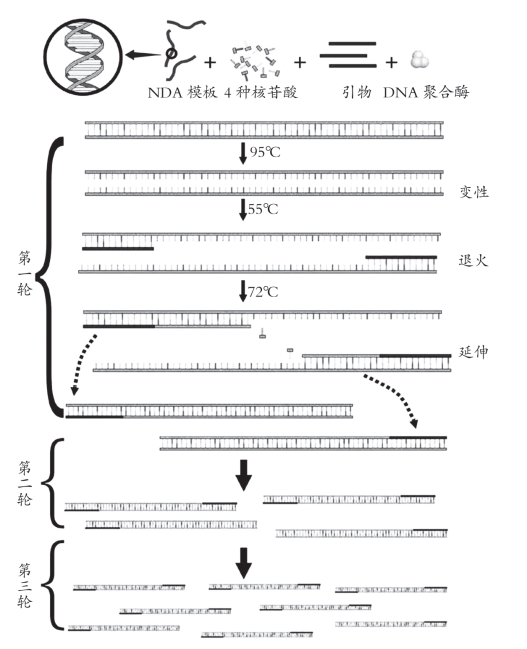
图2-1 PCR的反应历程
1.模板DNA的变性 模板DNA加热到90~95℃时,双螺旋结构的氢键断裂,双链解开成为单链,称为DNA的变性,以便它与引物结合,为下轮反应作准备。变性温度与DNA中G-C含量有关,G-C间由三个氢键连接,而A-T间只有两个氢键相连,所以G-C含量较高的模板,其解链温度相对要高些。故PCR中DNA变性需要的温度和时间与模板DNA的二级结构的复杂性、G-C含量高低等均有关。对于高G-C含量的模板DNA在实验中需添加一定量二甲基亚砜(DMSO),并且在PCR循环中起始阶段热变性温度可以采用97℃,时间适当延长,即所谓的热启动。
2.模板DNA与引物的退火 将反应混合物温度降低至37~65℃时,寡核苷酸引物与单链模板杂交,形成DNA模板-引物复合物。退火所需要的温度和时间取决于引物与靶序列的同源性程度及寡核苷酸的碱基组成。一般要求引物的浓度大大高于模板DNA的浓度,并由于引物的长度显著短于模板的长度,因此在退火时,引物与模板中的互补序列的配对速度比模板之间重新配对成双链的速度要快得多,退火时间一般为1~2min。
3.引物的延伸 DNA模板-引物复合物在Taq DNA聚合酶的作用下,以dNTP为反应原料,靶序列为模板,按碱基配对与半保留复制原理,合成一条与模板DNA链互补的新链。重复循环变性—退火—延伸三过程,就可获得更多的“半保留复制链”,而且这种新链又可成为下次循环的模板。延伸所需要的时间取决于模板DNA的长度。在72℃条件下,Taq DNA聚合酶催化的合成速度大约为40~60个碱基/秒。经过一轮“变性—退火—延伸”循环,模板拷贝数增加了一倍。在以后的循环中,新合成的DNA都可以起模板作用,因此每一轮循环以后,DNA拷贝数就增加一倍。每完成一个循环需2~4min,一次PCR经过30~40次循环,约2~3h。扩增初期,扩增的量呈直线上升,但是当引物、模板、聚合酶达到一定比值时,酶的催化反应趋于饱和,便出现所谓的“平台效应”,即靶DNA产物的浓度不再增加。
PCR的三个反应步骤反复进行,使DNA扩增量呈指数上升。反应最终的DNA扩增量可用Y=(1+X)n计算。Y代表DNA片段扩增后的拷贝数,X表示平均每次的扩增效率,n代表循环次数。平均扩增效率的理论值为100%,但在实际反应中平均效率达不到理论值。反应初期,靶序列DNA片段的增加呈指数形式,随着PCR产物的逐渐积累,被扩增的DNA片段不再呈指数增加,而进入线性增长期或静止期,即出现“停滞效应”,这种效应称平台期。大多数情况下,平台期的到来是不可避免的。
PCR扩增产物可分为长产物片段和短产物片段两部分。短产物片段的长度严格地限定在两个引物链5′端之间,是需要扩增的特定片段。短产物片段和长产物片段是由于引物所结合的模板不一样而形成的,以一个原始模板为例,在第一个反应周期中,以两条互补的DNA为模板,引物是从3′端开始延伸,其5′端是固定的,3′端则没有固定的止点,长短不一,这就是“长产物片段”。进入第二周期后,引物除与原始模板结合外,还要同新合成的链(即“长产物片段”)结合。引物在与新链结合时,由于新链模板的5′端序列是固定的,这就等于这次延伸的片段3′端被固定了止点,保证了新片段的起点和止点都限定于引物扩增序列以内、形成长短一致的“短产物片段”。不难看出“短产物片段”是按指数倍数增加,而“长产物片段”则以算术倍数增加,几乎可以忽略不计,这使得PCR的反应产物不需要再纯化,就能保证足够纯的DNA片段供分析与检测用。
(二)PCR反应的五个元素
参与PCR反应的物质主要为五种:引物、酶、dNTP、模板和Mg2+。
1.引物 引物是PCR特异性反应的关键,PCR产物的特异性取决于引物与模板DNA互补的程度。理论上,只要知道任何一段模板DNA序列,就能按其设计互补的寡核苷酸链做引物,利用PCR就可将模板DNA在体外大量扩增。引物设计有3条基本原则:首先引物与模板的序列要紧密互补,其次引物与引物之间避免形成稳定的二聚体或发夹结构,再次引物不能在模板的非目的位点引发DNA聚合反应(即错配)。
引物的选择将决定PCR产物的大小、位置以及扩增区域的Tm值这个和扩增物产量有关的重要物理参数。好的引物设计可以避免背景和非特异产物的产生,甚至在RNA-PCR中也能识别cDNA或基因组模板。引物设计也极大地影响扩增产量:若使用设计粗糙的引物,产物将很少甚至没有;而使用正确设计的引物得到的产物量可接近于反应指数期的产量理论值。当然,即使有了好的引物,依然需要进行反应条件的优化,比如调整Mg2+浓度,使用特殊的共溶剂如二甲基亚砜、甲酰胺和甘油。对引物的设计不可能有一种包罗万象的规则确保PCR的成功,但遵循某些原则,则有助于引物的设计。
(1)引物长度:PCR特异性一般通过引物长度和退火温度来控制。引物的长度一般为15-30bp,常用的是18~27bp,但不应大于38bp。引物过短时会造成Tm值过低,在酶反应的最适温度时不能与模板很好地配对;引物过长时又会造成Tm值过高,超过酶反应的最适温度,还会导致其延伸温度大于74℃,不适于Taq DNA聚合酶进行反应,而且合成长引物还会大大增加合成费用。
(2)引物碱基构成:引物的G+C含量以40~60%为宜,过高或过低都不利于引发反应,上下游引物的G—C含量不能相差太大。其Tm值是寡核苷酸的解链温度,即在一定盐浓度条件下,50%寡核苷酸双链解链的温度,有效启动温度,一般高于Tm值5~10℃。若按公式Tm=4(G+C)+2(A+T)估计引物的Tm值,则有效引物的Tm为55~80℃,其Tm值最好接近72℃以使复性条件最佳。引物中四种碱基的分布最好是随机的,不要有聚嘌呤或聚嘧啶的存在。尤其3′端不应超过3个连续的G或C,因这样会使引物在G+C富集序列区错误引发。
(3)引物二级结构:引物二级结构包括引物自身二聚体、发卡结构、引物间二聚体等。这些因素会影响引物和模板的结合从而影响引物效率。对于引物的3′末端形成的二聚体,应控制其ΔG大于-5.0 kcaL/mol或少于三个连续的碱基互补,因为此种情形的引物二聚体有进一步形成更稳定结构的可能性,引物中间或5′端的要求可适当放宽。引物自身形成的发卡结构,也以3′端或近3′端对引物—模板结合影响更大;影响发卡结构的稳定性的因素除了碱基互补配对的键能之外,与茎环结构形式亦有很大的关系。应尽量避免3′末端有发卡结构的引物。
(4)引物3′端序列:引物3′末端和模板的碱基完全配对对于获得好的结果是非常重要的,而引物3′末端最后5到6个核苷酸的错配应尽可能少。如果3′末端的错配过多,通过降低反应的退火温度来补偿这种错配不会有什么效果,反应几乎注定要失败。
引物3′末端的另一个问题是防止一对引物内的同源性。应特别注意引物不能互补,尤其是在3′末端。引物间的互补将导致不想要的引物双链体出现,这样获得的PCR产物其实是引物自身的扩增。这将会在引物双链体产物和天然模板之间产生竞争PCR状态,从而影响扩增成功。
引物3′末端的稳定性由引物3′末端的碱基组成决定,一般考虑末端5个碱基的ΔG。ΔG值是指DNA双链形成所需的自由能,该值反映了双链结构内部碱基对的相对稳定性,此值的大小对扩增有较大的影响。应当选用3′端ΔG值较低(绝对值不超过9),负值大,则3′末端稳定性高,扩增效率更高。引物的3′端的ΔG值过高,容易在错配位点形成双链结构并引发DNA聚合反应。(www.daowen.com)
需要注意的是,如扩增编码区域,引物3′端不要终止于密码子的第3位,因密码子的第3位易发生简并,会影响扩增特异性与效率。另外末位碱基为A的错配效率明显高于其他3个碱基,因此应当避免在引物的3′端使用碱基A。
(5)引物的5′端序列:引物的5′端限定着PCR产物的长度,它对扩增特异性影响不大。因此,可以被修饰而不影响扩增的特异性。引物5′端修饰包括:加酶切位点;标记生物素、荧光、地高辛、Eu3+等;引入蛋白质结合DNA序列;引入突变位点、插入与缺失突变序列和引入一启动子序列等。对于引入一至两个酶切位点,应在后续方案设计完毕后确定,便于后期的克隆实验,特别是在用于表达研究的目的基因的克隆工作中。
(6)引物的特异性:引物与非特异扩增序列的同源性不要超过70%或有连续8个互补碱基同源,特别是与待扩增的模板DNA之间要没有明显的相似序列。
2.酶及其浓度 Taq DNA多聚酶是耐热DNA聚合酶,是从水生栖热菌(Thermus aquaticus)中分离的。Taq DNA聚合酶是一个单亚基,分子量为94 000 Da。具有5′→3′的聚合酶活力,5′→3′的外切核酸酶活力,无3′→5′的外切核酸酶活力,会在3′末端不依赖模板加入1个脱氧核苷酸(通常为A,故PCR产物克隆中有与之匹配的T载体),在体外实验中,Taq DNA聚合酶的出错率为10-5~10-4。此酶的发现使PCR广泛地被应用。
此酶具有以下特点:①耐高温,在70℃下反应2h后其残留活性在90%以上,在93℃下反应2h后其残留活性仍能保持60%,而在95℃下反应2h后为原来的40%;②在热变性时不会被钝化,故不必在扩增反应的每轮循环完成后再加新酶;③一般扩增的PCR产物长度可达2kb,且特异性也较高。
PCR的广泛应用得益于此酶,目前各试剂公司中开发了多种类型的Taq酶,有用于长片段扩增的酶,扩增长度极端可达40kb;有在常温条件下即可应用的常温PCR聚合酶;还有针对不同实验对象的酶等。
一典型的PCR反应约需的酶量为2.5U(总反应体积为50 L时),浓度过高可引起非特异性扩增,浓度过低则合成产物量减少。
3.dNTP的质量与浓度 dNTP的质量与浓度和PCR扩增效率有密切关系,dNTP粉呈颗粒状,如保存不当易变性失去生物学活性。dNTP溶液呈酸性,使用时应配成高浓度,以1M NaOH或1M Tris。HCl的缓冲液将其pH调节到7.0~7.5,少量分装,-20℃冰冻保存。多次冻融会使dNTP降解。在PCR反应中,dNTP应为50~200mol/L,尤其是注意4种dNTP的浓度要相等(等摩尔配制),如其中任何一种浓度不同于其他几种时(偏高或偏低),就会引起错配。浓度过低又会降低PCR产物的产量。dNTP能与Mg2+结合,使游离的Mg2+浓度降低。
4.模板(靶基因)核酸 模板核酸的量与纯化程度,是PCR成败的关键环节之一,传统的DNA纯化方法通常采用SDS和蛋白酶K来消化处理标本。SDS的主要功能是:溶解细胞膜上的脂类与蛋白质,因而溶解膜蛋白而破坏细胞膜,并解离细胞中的核蛋白,SDS还能与蛋白质结合而沉淀;蛋白酶K能水解消化蛋白质,特别是与DNA结合的组蛋白,再用有机溶剂(酚与氯仿)抽提除去蛋白质和其他细胞组分,用乙醇或异丙醇沉淀核酸,该核酸即可作为模板用于PCR反应。一般临床检测标本,可采用快速简便的方法溶解细胞,裂解病原体,消化除去染色体的蛋白质使靶基因游离,直接用于PCR扩增。
模板DNA投入量对于细菌基因组DNA一般在1~10ng/L,实验中模板浓度常常需要优化,一般可选择几个浓度梯度(浓度差以10倍为一个梯度)。在PCR反应中,过高的模板投入量往往会导致PCR实验失败。
5.Mg2+浓度 Mg2+对PCR扩增的特异性和产量有显著的影响,在一般的PCR反应中,各种dNTP浓度为200mol/L时,Mg2+浓度为1.5~2.0mmol/L为宜。Mg2+浓度过高,反应特异性降低,出现非特异扩增,浓度过低会降低Taq DNA聚合酶的活性,使反应产物减少。一般厂商提供的Taq DNA聚合酶均有相应的缓冲液,而Mg2+也已添加,如果特殊实验应采用无Mg2+的缓冲液,在PCR反应体系中添加一定量的Mg2+。
(三)PCR反应特点
1.强特异性 PCR反应的特异性决定因素为:①引物与模板DNA特异性的结合;②碱基配对原则;③Taq DNA聚合酶合成反应的忠实性;④靶基因的特异性与保守性。
其中引物与模板的正确结合是关键,引物与模板的结合及引物链的延伸是遵循碱基配对原则的。聚合酶合成反应的忠实性及Taq DNA聚合酶耐高温性,使反应中模板与引物的结合(复性)可以在较高的温度下进行,结合的特异性大大增加,被扩增的靶基因片段也就能保持很高的正确度。再通过选择特异性和保守性高的靶基因区,其特异性程度就更高。
2.高灵敏度 PCR产物的生成量是以指数方式增加的,能将皮克(pg=10-12g)量级的起始待测模板扩增到微克(g=10-6g)水平。能从100万个细胞中检出一个靶细胞;在病毒的检测中,PCR的灵敏度可达3个RFU(空斑形成单位);在细菌学中最小检出率为3个细菌。
3.快速简便 PCR反应用耐高温的Taq DNA聚合酶,一次性地将反应液加好后,即在PCR仪上进行变性-退火-延伸反应,反应一般在2~4h完成。扩增产物常用电泳分析,操作简单易推广,如采用特殊PCR仪(荧光实时定量PCR仪)则可全程监测PCR反应的结果,故耗时将更短。
4.低纯度模板 不需要分离病毒或细菌及培养细胞,DNA粗制品及总RNA等均可作为扩增模板。可直接用临床标本如血液、体腔液、洗漱液、毛发、细胞、活组织等粗制的DNA扩增检测。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





