生物法拆分可直接利用微生物(微生物法),也可直接使用游离酶(酶法)。主要途径是以微生物或酶立体选择性水解(酯、酰胺和腈)、酯化和芳烃氧化等。
7.3.2.1 微生物或酶立体选择性水解2-芳基丙酸酯
对2-芳基丙酸酯的催化不对称水解反应研究较多,2-芳基丙酸酯经脂肪酶催化水解,可得(S)-2-芳基丙酸(见图7-9)。
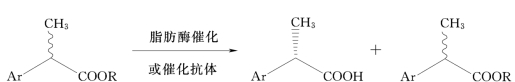
图7-9 酶催化水解拆分芳基丙酸酯反应
Giu等研究发现来源于根霉(Rhizopus)、毛霉(Mucor)和假丝酵母(Candida)属的胞外脂肪酶均对不同的萘普生酯具有很高的立体选择性,且稳定性和底物耐受性很高(>1mol/L)。在这些脂肪酶中,只有假丝酵母脂肪酶水解(±)-萘普生酯得到(S)-(+)-萘普生,其他微生物脂肪酶都得到(R)-萘普生。研究还发现,对同一脂肪酶,消旋酸氯乙酯的转化率较消旋酸甲酯大得多,但后者产品的光学纯度较前者为高。作者认为底物结构的微小变化对酶的选择性有较大影响。Tsai等在研究脂肪酶不对称水解布洛芬酯时也得到相似的结论。辛嘉英等对异辛烷-水双液相体系中脂肪酶拆分消旋萘普生甲酯进行研究,结果显示:温度为37℃、缓冲液pH值为7.5、水含量2%、转化率24.3%时,可得e.e.值为94.9%的(S)-萘普生。胡允金等采用多克隆抗体对映选择性催化萘普生乙酯水解。结果表明,多克隆抗体能对映选择性地催化水解(R)-对映体,它与脂肪酶仅水解对映体的情形正好相反。
也可直接利用微生物的立体选择性水解反应。用丝孢酵母(Trichosporon)催化(±)-酮洛芬乙酯的立体选择性水解,可得到光学纯度95%的(S)-酮洛芬。徐诗伟等研究人员筛选到一株几乎无脂肪酶活力,但能高度立体选择性水解(±)-布洛芬酯为(S)-(+)-布洛芬的酵母菌T158,鉴定为皮状丝孢酵母,水解(±)-布洛芬甲酯或异丙酯得到e.e.>97%的(S)-(+)-布洛芬。一些微生物还可以优先水解(R)-构型的2-芳基丙酸酯。Sepracor公司的Heefner等研究人员用筛选得到的Beauveria bassiana对外消旋酮洛芬胆碱酯进行立体选择性水解,其优先水解(R)-构型。
在实际过程中,为降低拆分成本,往往使用微生物粗酶制剂,而这有时会导致酶的立体选择性降低。为提高粗酶的立体选择性,可对酶制剂进行一定的处理或者对反应的微环境进行调控。
夏仕文等以2-丙醇处理脂肪酶,用于催化酮洛芬氯乙酯的水解反应,(S)-酮洛芬的光学纯度为93.4%e.e.,而未经处理的粗酶催化的产物光学纯度仅为66.1%e.e.。刘幽燕通过添加表面活性剂如吐温-80、壬基酚聚氧乙烯醚等,能显著提高脂肪酶催化拆分酮洛芬的活性和立体选择性,在存在浓度20mg/m L的吐温-80或30mg/m L壬基酚聚氧乙烯醚时,假丝酵母酶的活性可提高13倍或15倍,立体选择性提高15倍。
固定化酶用于拆分外消旋体,可使酶重复使用和稳定化,降低成本,使之成为易于控制、便于大规模工业化生产的生物催化剂。固定化大多采用吸附、交联和包埋等方法。
Moreno将圆柱状假丝酵母(Candida cylindracea)脂肪酶共价固定在三氧化二铝、二氧化硅和大孔玻璃上,在水溶液中催化乳液状2-苯基丙酸酯不对称水解,发现固定在三氧化二铝和二氧化硅上的脂肪酶的活性较固定在大孔玻璃上的高,作者认为主要是由于传质因素限制了底物向大孔玻璃内酶分子的扩散造成的。在批式反应反复使用3次后,固定化酶活性仅存50%。
Battistel等将圆柱状假丝酵母脂肪酶(CCL)以吸附法固定在弱极性Amberlite XAD 7树脂上,将500g此固定化酶装填到柱式反应器中,用于液态底物(±)-萘普生乙氧基乙酯的不对称水解。连续操作1200h,得到1.8kg,其e.e.>95%。还有将脂肪酶先吸附在弱极性Amberlite XAD 7树脂上,再用戊二醛交联的方法制备固定化酶,用于催化布洛芬酯的不对称水解,得到e.e.>99%的(S)-(+)-布洛芬,转化率为44%,反复使用后其酶活力仍保持在90%以上。刘幽燕等将脂肪酶先吸附在硅胶上再用戊二醛交联制备固定化酶,用于催化酮洛芬氯乙酯的不对称水解,通过吐温-80将酶的立体选择性由10提高到100以上。转化率为48%,光学纯度为97%e.e.,连续进行6次批式反应,酶活性仍保留61%。
辛嘉英等以YWG-C6H5作载体固定化脂肪酶催化消旋萘普生甲酯水解,反应120h,转化率为25%,(S)-萘普生的光学纯度为94%e.e.,且发现添加乳糖后,固定化酶批式连续反应器半衰期达1000h以上。徐毅等将脂肪酶固定于硅藻土上,催化萘普生氯乙酯不对称水解,反应24h转化率达35%,光学纯度为93%e.e.。
近来,利用多相萃取酶膜生物反应器的新技术生产光学纯对映体格外引人注目,如吉鑫松等将脂肪酶固定在8根36cm长、表面积为55cm2的中空纤维中,利用该反应器水解1%外消旋布洛芬乙酯,得到e.e.值为80%的(S)-(+)-布洛芬;Matson等用固定了CCL的中空纤维多相萃取半透膜生物反应器连续水解(±)-萘普生甲酯、(±)-布洛芬三氟乙酯分别得到了光学纯的(S)-(+)-萘普生和(S)-(+)-布洛芬。这一技术的采用既可提高酶促反应能力,又可利用中空纤维的半透膜使产物和底物分开、使水层与有机层分开,从而达到既催化又分离的目的。
交联酶晶体(CLCE)与粗酶比较,其优点在于稳定性好、活性强、对映选择性高,如其在有机溶剂中稳定性是粗酶的几十到几百倍,在水解消旋的2-芳基丙酸酯时的对映选择性比相应粗酶制剂高3~50倍。
7.3.2.2 腈、酰胺的水解
在有机合成中,氰基易作为“水稳定负碳离子”引入有机化合物,而腈类化合物则是一种多用途的中间体,能转化为胺、酰胺、羧酸和羰基化合物等。用微生物酶水解腈为酰胺和羧酸时,由于反应条件温和(如pH值为中性和常温常压)以及纯的产物使之成为一种很有吸引力的方法,迄今为止在工业生产上已有许多成功的例子。这些年来,颇有意义的是研究用微生物酶立体选择性水解腈类制备光学活性2-芳基丙酸(2-APA),其路线主要有两条:一是用微生物腈水解酶(nitrilase)直接立体选择性水解拆分2-芳基丙腈为光学纯的2-芳基丙酸;二是用腈水合酶(nitrile hydratase)和酰胺酶(amidase)相结合立体选择性水解拆分2-芳基丙腈为光学纯的2-芳基丙酸,在该过程中,第一种酶水合腈为酰胺,第二种酶水解酰胺为羧酸。光学活性2-APA可作为药物活性基质特别是作为非甾体抗炎药(NSAID)应用。药理临床的新研究表明2-APA类NSAID的一对对映体中仅(S)-(+)-构型显示高的药理作用,(R)-(-)-构型活性低或无作用。一般化学反应所产生的手性中心总是得到等量的一对对映体混合物,称之为外消旋体。欲得到光学纯(S)-(+)-2-APA,用微生物酶法拆分可提供一个经济的选择,尤其将固定化、多相反应、膜反应器和基因克隆等新技术引入酶促反应,使生物法拆分更具特色。本文就其两种不同的拆分途径作一简要介绍(见图7-10)。
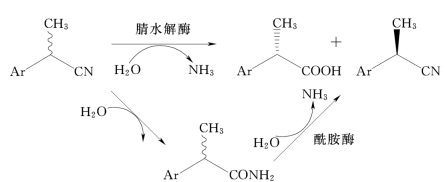
图7-10 酶催化水解拆分芳基丙腈(酰胺)反应
1.腈水解酶直接立体选择性水解拆分(±)-2-AP-CN为(S)-(+)-2-APA
研究发现玫瑰色红球菌(Rhodococcus rhodochrous)J1产生的腈水解酶既可作用于脂肪族腈,也可作用于芳香族腈并将其水解为相应的羧酸。Yamamoto等筛选的一些微生物,可立体选择性水解腈或酰胺制备(S)-(+)-2 APA,其中产生(S) (+)-2-丙氨酸或(S)-(-)-布洛芬(Ibuprofen)的微生物不动杆菌(Acinetobacter sp.)AK226能高度立体选择性水解(±)-2-(4-异丁基苯)丙腈(Ibu-CN)为(S)-(+)-布洛芬。用该菌休眠细胞水解(±)-Ibu CN,可产生对映体过量(e.e.)为95%的(S)-(+)-布洛芬,![]() =+54.0°,收率23%,没有伴随产生2-(4-异丁基苯)丙酰胺(Ibu-CONH2),也不水解Ibu-CONH2为(S)-(+)-布洛芬。可见,该不动杆菌仅产腈水解酶,对(S)-(-)-Ibu-CN具有高度选择性。
=+54.0°,收率23%,没有伴随产生2-(4-异丁基苯)丙酰胺(Ibu-CONH2),也不水解Ibu-CONH2为(S)-(+)-布洛芬。可见,该不动杆菌仅产腈水解酶,对(S)-(-)-Ibu-CN具有高度选择性。
2.腈水合酶(nitrile hydratase)和酰胺酶(amidase)相结合立体选择性水解拆分(±)-2 AP CN为(S)-(+)-2-APA(https://www.daowen.com)
用两种酶结合水解腈为相应羧酸的反应中,酰胺为中间产物。第一种酶水合腈为酰胺,第二种酶水解酰胺为羧酸。Gilligan等从土壤中分离到的马红球菌(R.equi)TG328能有效水解拆分(±)-2-苯丙腈为(S)-(+)-2-苯丙酸。这一转化由上述两种酶催化,即首先由无立体选择性腈水合酶使(±)-2-苯丙腈转化为(±)-2-苯丙酰胺,然后由另一种具有高度立体选择性的酰胺酶水解(S)-(+)-酰胺为(S)-(+)-2-苯丙酸。用马红球菌TG328休眠细胞在10℃下反应30h可产生100g/L(S)-(+)-2-苯丙酸,e.e.值为99.4%;同时分离出e.e.值为99.0%的(R)-(-)-2-苯丙酰胺。此外,作者还发现一些菌株显示出腈水合酶活力,它们对(±)-2-苯丙腈的一种对映体有立体专一性,可用于制备(S)-(+)-2-苯丙酰胺或(R)-(-)-2-苯丙酰胺。Mayaux等也曾发现具有酰胺酶活力的短杆菌(Brevibacterium sp.)R312能立体选择性水解一些(±)-2-芳基丙酰胺(如2-苯丙酰胺)和2-芳氧基丙酰胺[如2-(4-羟基苯氧)丙酰胺],分别得到相应(S)-(+)-羧酸或(R)-(-)-羧酸,e.e.值为93%~95%。短杆菌R312的完整细胞和可溶性的细胞提取液中酰胺酶活力分别为1mg细菌蛋白0.25U和0.40U;将短杆菌R312粗酶提取液经硫酸铵分级沉淀、苯-琼脂糖色谱和凝胶过滤等步骤纯化;纯化后比活力提供31倍,纯度约80%,回收率为6.3%,纯蛋白的立体选择性e.e.>95%;测定纯化后酰胺酶的蛋白质序列,进行菌落杂交,基因克隆到大肠杆菌中表达酶活,由核苷酸序列分析得到证实酰胺酶基因与腈水合酶基因偶合的结构证据。
Turner等用固定化完整细胞催化剂SP361(由红球菌CH5细胞固定在离子交换树脂上得到)转化各种2-芳基乙腈或2-芳基酰胺制备光学活性酰胺和/或羧酸时,用(±)-2-苯丙腈、(±)-2-苯丁腈、(±)-2-(4-甲基苯)丙腈和(±)-2-Ibu-CN及其相应结构的酰胺作为转化基质,发现SP361水解前三种腈得到(R)-酰胺和(S)-羧酸;而水解(±)-Ibu-CN得到的只是(R)-羧酸,没有酰胺产生。另一方面,用SP361水解(±)-2-苯丁酰胺、(±)-2-(4-甲基苯)丙酰胺和(±)-Ibu-CONH2时均得到(S)-羧酸。可见,SP361酶系含有较好的立体选择性催化上述两类不同反应的腈水合酶和酰胺酶,而无腈水解酶活力,底物腈结构的不同可影响产物羧酸的绝对构型,作者推测了该酶系对上述不同腈的两种作用模式。此外,发现SP361酶系还具有立体选择性水解潜手性二腈化合物的能力。
3.两种水解拆分途径的结合
Kakeya等筛选以2-氰基乙醇或苄腈作为惟一氮源生产的微生物,选到一株丁烷红球菌(R.butanica)ATCC21197,发现降解腈的3种酶(腈水解酶、腈水合酶和酰胺酶)是由在培养基中添加ε-己内酰胺诱导产生的。能成功地动态拆分(±)-2-AP-CN、如(±)-2-Ibu-CN、(±)-2-(4-氯苯)丙腈和(±)-2-(4-甲氧基苯)丙腈为酰胺和(S)-羧酸。除了得到满意收率的(S)-羧酸外,还均得到高收率和高e.e.值的(R)-酰胺。可见,该酶系按图7-10两种途径进行水解拆分,其中以腈水合酶与酰胺酶结合方式为主,且腈水合酶活力最高。由于(R)-酰胺在酸性条件下[3mol/L硫酸/乙酸(1∶2),回流12h]水解为(R)-羧酸,本质上不发生消旋化。因此利用丁烷红球菌可同时制备2-APA的一对对映体。Gilligan等对上述两种由腈类制备(S)-(+)-2-APA的不同途径曾有所评价。用腈水解酶直接水解时,由于反应所剩下的(R)-(+)-2-AP-CN通常对细胞物理损伤较大,能抑制腈水解酶活力。同时,腈还是一种催泪毒剂,对人类健康会构成危害。在用腈水合酶和酰胺酶相结合的水解体系中,未反应的基质2-AP-CONH2对细胞损害较小且不易挥发,因此下游纯化过程较安全。在双酶配合过程中,也发现腈水合酶常受酰胺酶反应产物(S)-(+)-羧酸和铵离子的抑制。抑制作用是因腈水合酶活性中心趋于疏水性,当存在上述产物时,能与酶以盐桥型相互作用,形成稳定的络合物成为竞争性抑制剂。综上所述,在利用微生物酶制备(S)-(+)-2-APA中,立体选择性水解腈类开辟了可供选择的又一新途径。20世纪90年代以来,已为许多研究者所关注,将成为手性化合物(腈、酰胺和羧酸)的研究和制备的一个新热点。
7.3.2.3 酶催化酯化
众所周知,如果水被微水有机溶剂取代,脂肪酶就可以立体选择性地催化酯水解的逆反应——酯合成反应。在有机溶剂中进行的酯化反应具有如下优点:①增加了2-芳基丙酸类药物及其衍生物的溶解度;②避免了化学水解引起的产品酸光学纯度下降;③增强了酶的刚性,提高稳定性;④通过改变溶剂体系,可以增加酶的立体选择性;⑤酶与底物或产物易于分离;⑥由于事先不必酯化,简化了拆分步骤。
酶催化酯化反应拆分2-芳基丙酸反应见图7-11,目前已有许多利用脂肪酶立体选择性地催化酯合成反应拆分2-芳基丙酸类药物的报道。
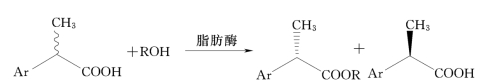
图7-11 2-芳基丙酸的脂肪酶催化的酯化反应
通过酯化途径进行拆分,是与有机相酶反应的研究息息相关的。来源于皱落假丝酵母(Candida rugosa)、根霉(Rhizomucor miehei)、南极假丝酵母(Candida Antarctica)等的脂肪酶均可用于2-芳基丙酸酯化的拆分。如Novo公司的Lipozyme 1000L(来源于Rhizomucor miehei)用于催化(R,S)-布洛芬与辛醇的选择性酯化反应,优先选择(S)-构型,对映选择率(E)>100;不过对于酮洛芬,优先选择(R)-构型,且E值仅有2.4。
通过改变醇种类和浓度、溶剂的种类、体系水含量(活度)等因素可以改变酶的活性和选择性。Tsai等在微水的异辛烷中利用CCL催化(±)-萘普生和醇的酯化反应得到(S)-(+)-萘普生酯时,发现醇的性质对酶催化活性和立体选择性的影响很大,当用三甲基硅基甲醇时,酶催化活性和立体选择性明显增大。作者认为这是由于硅原子比碳原子具有较低的电负性、较大的原子半径,从而更有利于脂肪酶对其分子的识别所致。进一步的研究发现,在有较高lgP值(P为一个特定的有机溶剂在水和正辛烷两相溶液中的分配系数,lgP值越高,表示疏水性越强)的有机溶剂中,虽然脂肪酶的酯化活性和立体选择性较高,但由于底物萘普生在高lgP值的有机溶剂如异辛烷中溶解度太低(1.8mmol/L),因此酯化产率较低。综合以上两点考虑,采用了60%异辛烷和40%甲苯的混合溶剂体系进行反应,在不损失立体选择性的前提下,提高了萘普生的酯化产率。许建和等采用同样的混合溶剂体系用脂肪酶催化酮洛芬的酯化反应,得到了相似的结论,并发现脂肪酶的对映体选择性随混合溶剂中甲苯含量的变化而发生逆转。
除了使用不同的溶剂和醇可以改变酶的对映体选择性外,在非水溶剂中加入表面活性剂,对酶的催化活性和立体选择性同样有影响。如Tsai等采用圆柱状假丝酵母(Candida cylindracea)脂肪酶在异辛烷中催化萘普生与三甲基硅基甲醇的酯化反应发现,在反应体系中加入AOT可明显提高底物萘普生在异辛烷中的溶解度,并发现醇是脂肪酶的竞争抑制剂,而AOT是脂肪酶的非竞争抑制剂,因此在反应体系中加入适量的AOT可明显提高(S)-萘普生的产量和脂肪酶的选择性。
用CCL在油包水的反相胶束(AOT/异辛烷)中,进行(R,S)-布洛芬与正丙醇的酯化反应,当w0{[H2O]/[AOT]}为12时,其立体选择性比率E>150,转化率达32%,得到(S)-(+)-布洛芬丙酯的e.e.值为100%,(R)-(-)-布洛芬几乎未被酯化。该CCL的高度立体选择性仅出现在反相胶束体系中,而在单纯有机溶剂体系(异辛烷)中进行酯合成(E=3.0,转化率为41%)和在含水体系(含1%二甲基亚砜的Hepes缓冲液)中进行酯水解(E=1.3,转化率为32%),均得不到如此高的立体选择性。作者认为,酶在不同体系中立体选择性差异主要归因于界面现象。在反相胶束体系中由于表面活性剂分子形成反相微胶层使溶解酶的水与溶解底物的溶剂分隔开产生相当大面积的界面,而在纯有机溶剂体系(无表面活性剂)及含水体系中不存在此界面。
向主体溶剂中适当加入少量的添加剂不但对酶的活性有影响,而且对酶的立体选择性也有很大影响。添加剂既包括一些极性分子如乙二醇、丙三醇及酰胺之类的极性分子,也包括冠醚及其类似物之类的非极性分子。段纲等在有机溶剂中对布洛芬进行酶促酯化反应时加入少量的极性溶剂,酶的选择性有了明显提高,如加入了二甲基甲酰胺后,最后得到(S)-布洛芬的e.e.值从57.7%增加到了91%。而西班牙的Gradillas等对布洛芬酯化的反应速率进行了研究,当未加任何添加剂时,当反应进行30h后,(S)-布洛芬的产率为43%,而加入了苯并冠醚后,同样的反应时间,产率提高到68%,加入了内消旋的四苯基卟啉后,反应产率提供到了79%,对对映体选择性则无大的影响。
酯化反应的难点在于水活度的控制。酯化反应是一个产水的过程,而水量的增加会导致酯化反应的逆反应——水解反应的发生。为了保证反应能够连续朝合成方向进行,必须在反应过程中不断地排除产生的水,如在无溶剂或在有机溶剂减压条件下进行布洛芬的酯化反应,就可有效地减少副产物水的量。
近年来由于发现2-芳基丙酸类药物有肠胃副反应如造成肠胃溃疡和出血,一种采用2-羟基酰胺、4-吗啉代乙醇等合成水溶性光学活性2-芳基丙酸酯类药物前体的方法已被提出,并受到了人们的重视。
7.3.2.4 酶催化氧化
对映纯的2-芳基丙酸还可经芳烃的氧化制备。商品化的脱氢酶一般价格昂贵,辅酶的再生非常麻烦,而且不一定具备我们所希望的选择性,因此在大规模生产时通常只使用微生物细胞作催化剂。所以关键是能否选育出高效、专一的微生物菌种。这方面也有不少报道:Bertola等报道了采用微生物发酵法,氧化2-(6-甲氧基-2-萘基)戊烷制备光学活性萘普生,e.e.值为100%;此外,Rossi用氧化还原酶[如Paeudomonas(假单胞菌)、Aeromonas(气单胞菌)等]将Darzens法生成的醛氧化成具有单一立体构型的布洛芬。
7.3.2.5 微生物去消旋化
不同于传统的生物催化的动力学拆分过程,微生物去消旋化制备光学活性的2-芳基丙酸的起始原料为消旋的2-芳基丙酸。在微生物的作用下,将消旋体的其中一个对映体,例如(R)-型,转变为另外一种对映体(S)-型。这方面也有一些报道:Kato等人利用来源于诺卡菌属(Nocardia diaphanozonaria)的微生物细胞催化消旋的2-苯基丙酸产生(R)-型的2-苯基丙酸,e.e.值为69%,产率为81%;对取代的2-苯氧基丙酸,产物为(S)-型的2-苯氧基丙酸,随取代基的不同,e.e.值为68%~69%,产率为64%~95%。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。








