7.1.5.1 前体化合物——苄基海因的制备工艺
已报道的5-取代海因的化学和合成方法较多,主要有Suzuki法、缩合加氢法和氨基酸关环法三种。
1.Suzuki法
Suzuki法是用醛、氰化钠和碳酸氢铵合成5-取代海因。该法的缺点是要使用剧毒物NaCN,这给安全操作、三废处理等方面带来困难,增加了成本,并且收率也不高。
2.缩合加氢法
缩合加氢法以海因为原料,将海因与醛缩合得到的5-不饱和取代海因,再经加氢生成5-饱和取代海因,途径见图7-1。该方法缩合收率均在95%以上,方法简单,在环保、产物收率等方面与Suzuki法相比有明显优势。
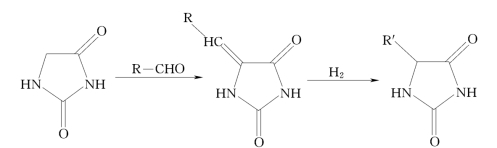
图7-1 5-饱和取代海因的合成路线
(1)5-不饱和取代海因的制备。海因是以5-位上的亚甲基与苯甲醛的羰基参与的羰-羰缩合反应,生成5-亚苄基海因。海因与芳香醛或杂环醛缩合反应的最佳催化剂是乙二胺,最佳反应时间位2~5h。亚苄基海因的摩尔收率达到95%以上。
(2)5-亚苄基海因加氢制备5-苄基海因。适量的5-亚苄基海因溶解于1mol/L NaOH溶液中,置于高压釜中,再加入用量为30%的Raney Ni催化剂,通H2在2.5k Pa和60~80℃下搅拌反应2~5h,反应结束后趁热过滤倾出物,调节pH值至7,得到产物沉淀,用水重结晶,过滤、干燥即得5-苄基海因。
3.氨基酸关环法
Courelius等发现α-氨基酸和氰酸盐能反应生成N-氨甲酰-α-氨基酸,经酸化关环后即可得到5-取代海因。
氨基酸关环法反应条件简单、收率高、产物纯度高,但需以能获得成本低廉的L-氨基酸或DL-氨基酸为前提,该法才具有通用性。
7.1.5.2 海因酶生物催化剂的制备
1.产酶菌种和特性研究
(1)产酶菌种。JS 01为南京工业大学实验室保存的菌种,具有D-海因酶和N-氨甲酰-D-氨基酸水解酶活力。经中国科学院微生物所鉴定,确认为属洋葱种伯克霍尔德(Burkholderia)。
(2)菌株的诱变。洋葱种伯克霍尔德(Burkholderia cepecia JS-01)已经证实可转化对羟基苄基海因(HPH)生成D-对羟苯甘氨酸(D-HPG)。以Burkholderia cepeciaJS-01为出发菌株,5-苄基海因(BH)转化成D-苯丙氨酸(D-Phe)的产物收率为筛子,对Burkholderia cepeciaJS-01进行了紫外诱变、5-氟尿嘧啶诱变和激光诱变。紫外诱变结合5-氟尿嘧啶梯度平板筛选菌种,可减少筛选工作量。所得突变株JS-01-44号对5-苄基海因的转化率提高到64.5%,连续10代斜面传代表明其酶转化活性稳定,其经50L发酵罐扩大培养也可保持62%左右的转化率。同时以JS-01-44号为出发菌株,采用200点Nd:YAG倍频脉冲激光诱变,经过粗筛及5代连续稳定性实验后,选育到一株高产菌Burkholderia cepecia 1003,转化率最高可达85.5%。
(3)菌株所含酶对底物的特异性。为考察诱变后的菌株Burkholderia cepecia 1003所含的D-海因酶和N-氨甲酰-D-氨基酸酶对底物的特异性,进行实验。配制5-取代海因的混悬水溶液150m L。底物浓度为15g/L,调节pH值至9.0,按底物对菌体的质量分数为0.5加入菌体(菌体经不同的诱导剂诱导),用氮气置换出瓶中空气,密封,于摇床中38℃下转化70h后,分别用毛细管电泳测定转化液中各组分的含量。
2.发酵产酶工艺
考察了发酵培养基中各种碳源、氮源对菌体生长及产酶的影响,并在不同的发酵条件下对菌株生长及产酶进行了研究。
(1)培养基。①斜面培养基,蛋白胨1%,牛肉浸膏0.3%,NaCl 0.5%,琼脂1.5%,p H=7.4。②种子培养基,葡萄糖2%,蛋白胨0.5%,玉米浆2.5%,牛肉膏0.5%,NaCl 0.3%,KH2PO40.2%,MgSO40.025%,CoCl20.005%,p H=7.0。③发酵培养基,葡萄糖2%,蛋白胨0.5%,玉米浆2.5%,NaCl 0.3%,KH2PO40.2%,MgSO40.025%,CoCl20.005%,p H=7.5。
(2)种子的培养。配制上述种子培养基在121℃下灭菌20min。冷却后接入种子,在32℃通风培养18h。
(3)发酵培养和菌体收集。配制上述发酵培养基3L于装5L的发酵罐中,121℃下灭菌20min。冷却后接入种子,然后在32℃通风培养20h。发酵液6000r/min离心20min,菌体备用。
7.1.5.3 酶法转化工艺
1.一菌双酶转化工艺
一菌双酶反应机理见图7-2。
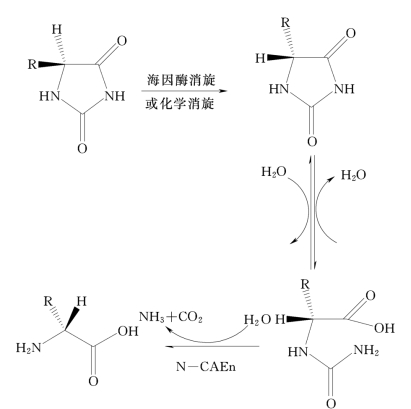
图7-2 一菌双酶法反应机理(https://www.daowen.com)
(1)酶对底物的立体选择性依赖的研究。迄今为止的研究表明,以5-取代海因经酶转化为D-型产物的过程基本上是D-型异构体作为底物。实验表明,对含D-海因酶和N-氨甲酰-D-氨基酸水解酶的菌体而言,其对底物光学活性的这种选择性是由D-海因酶完成的。上述实验结果表明,体系中的D-海因酶有很强的立体专一性,它只能转化D-型取代海因,而不能转化L-型取代海因。
(2)利用菌体进行的酶转化。称取一定量的底物5-取代海因,加入适量的水,调节pH值,加入质量为底物2倍的菌体,用氮气置换出瓶中气体,然后迅速塞好瓶塞,将其置于摇床中转化。转化5-取代海因制备D-氨基酸的最适转化条件是:pH值为9.0~9.5,温度38℃左右,转化40~72h后测定反应液中的D-氨基酸含量。
2.一酶一树脂法制备工艺
由于双酶转化工艺中海因酶和氨甲酰水解酶的活性相差较大,一般前者的活性为后者的5倍以上,故为提高D-苯丙氨酸的最终产率,综合了海因酶的高效转化特性,发展了苄基海因经海因酶催化制备N-氨甲酰-D-苯丙氨酸、再经酸催化化学水解得到D-苯丙氨酸的化学酶法工艺,即一酶一酸法,该方法的不足之处是酸水解产生了大量的废酸、废盐,环保处理压力大。一酶一树脂法是一酶一酸法的改进方法,通过采用强酸性树脂代替强酸,可避免反应中大量产生盐,从而减轻D-苯丙氨酸的分离纯化难度。该方法国外Roche公司开展过研究。
(1)一酶一树脂法的反应机理。一酶一树脂法是通过D-海因酶将苄基海因转化得到N-氨甲酰-D-苯丙氨酸,然后在强酸性树脂和亚硝酸钠的作用下,将N-氨甲酰-D-苯丙氨酸脱氨甲酰获得D-苯丙氨酸。该工艺的特点是:主要利用D-海因酶的光学选择性,获得D-型中间体,然后采用温和的化学方法将中间体变为光学纯产物。其主要反应过程见图7-3。
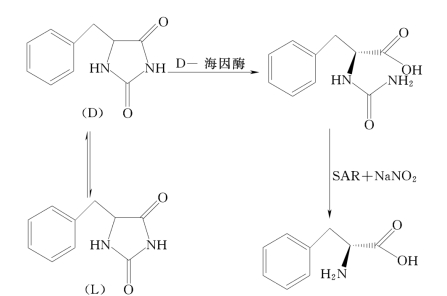
图7-3 一酶一树脂法反应路线
(2)一酶一树脂法的制备工艺。取发酵所得菌体,在菌体和苄基海因比为1∶1(质量比)、底物浓度为20g/L、38℃、pH值为9~9.5的密闭、充氮气条件下转化24h,N-氨甲酰-D-苯丙氨酸的转化得率为80%以上,转化液调节pH值至2~3即得目标产物的白色沉淀。
称取一定量的N-氨甲酰-D-苯丙氨酸(20g/L)溶于水,加入一定量的强酸性阳离子树脂,5~15℃,调节pH值并滴加亚硝酸钠溶液(亚硝酸钠与N-氨甲酰-D-苯丙氨酸摩尔比为1.2∶1),滴加结束后继续反应2h,反应完成后将反应物直接上柱分离,以纯水洗杂、0.8mol/L的氨水洗脱,产物D-苯丙氨酸的得率在80%以上。
7.1.5.4 D-苯丙氨酸的分离提取工艺
1.分离工艺路线
![]()
2.菌体絮凝和过滤除菌体
在D-苯丙氨酸的提取过程中,体系中由于细胞自溶,存在较多杂蛋白,从而使得过滤除杂的速度及其缓慢。采用无机絮凝剂进行杂蛋白的絮凝,可提高过滤的速度。采用两组无机反应剂CaCl2、KH2PO4与CaCl2、K2HPO4进行多次实验,转化液调节pH值至5.5~6.0,静止1h,过滤去除菌体细胞,收集清液。实验结果表明两组反应剂对D-苯丙氨酸的影响都比较小,但是鉴于过滤速度和经济方面的考虑,通常选择使用后一组絮凝剂。
3.膜超滤去除蛋白
利用超滤膜(截留分子量10000)过滤,去除过滤液中的蛋白,收集清液。
4.溶液脱色和浓缩结晶
研究表明糖用活性炭对转化液的脱色效果最好,活性炭用量为1.5%,pH值为6.5左右,温度为80~90℃,脱色时间为30min。再调节pH值至5~6,减压蒸馏可得D-苯丙氨酸白色晶体
7.1.5.5 D-苯丙氨酸的分析检验和质量标准
(1)D-苯丙氨酸的定性分析。采用纸层析法,D-苯丙氨酸的Rf值为0.65,展开剂组成为正丁醇∶乙酸∶水=6∶2∶2,显色剂为1%的茚三酮正丁醇溶液。
(2)D-苯丙氨酸的定量检验。采用高效液相色谱法测定,色谱柱为C18柱,流动相为乙腈∶20mmol/L磷酸二氢钾∶磷酸=25∶75∶0.1。流速1.0m L/min,紫外检测器波长202nm。
(3)D-苯丙氨酸的质量标准。由于D-苯丙氨酸是一种中间体产品,目前主要用于医药的合成,故未见公认的质量标准,参照L-苯丙氨酸的质量标准,制定了以下D-苯丙氨酸的质量指标。
1)性状,白色晶体或结晶状粉末,微溶于水,不溶于醇。
2)含量,不小于98.5%。
3)比旋光度,![]() =+33°~+35°(c=1,H2O)。
=+33°~+35°(c=1,H2O)。
4)干燥失重,不大于0.2%。
5)重金属,不大于20mg/kg。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






