在有机溶剂中酶的催化活性与有机溶剂的亲水性呈负相关性。酶通常在疏水性溶剂中的催化活性比在亲水性溶剂中高,这是因为疏水溶剂夺取酶分子表面必需水的能力比亲水性溶剂小。添加微量水到含酶的疏水性有机溶剂中或用其他方法提高体系的水活度,可使酶的催化活性升高,但是αw不能准确地预测极性有机溶剂对酶活性的影响,因为存在酶的溶剂化作用。
为了衡量酶与有机溶剂分子兼容性,以寻找能使酶发挥最高活性的有机溶剂,人们提出了多种表达溶剂性质的参数,如Hildebrandt溶解度参数δ、介电常数ε、偶极距μ等,但最常用最可靠的方法使用分配系数的对数值lgP。lgP是描述有机溶剂极性大小的参数,P值是溶剂在正辛醇和水中的分配系数比,lgP越大,溶剂的疏水性越强。常用有机溶剂的lgP值见相关文献。对表中未列到的溶剂,可用疏水片段常数法计算。
常用有机溶剂如DMSO、DMF、丙酮、低级醇等溶剂的lgP值小,能与水互溶。而与水不互溶的亲脂性溶剂如烷类、醚、芳香族化合物、卤代烃等则lgP较大。lgP值介于中间(0~3)的溶剂不宜作为酶催化反应的非水介质溶剂。只有在少数情况下,对强极性底物如多羟基化合物才考虑采用中等极性或与水互溶性溶剂如四氢呋喃、二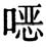 烷、嘧啶等,在这些溶剂中,除极少数特别稳定的酶如枯草杆菌蛋白酶外,绝大多数酶都会失活。一般认为,酶在疏水性大的介质中反应活性高,因此酶催化反应在非极性(apolar)或与水不混溶的(immiscible with water)疏水性有机溶剂中更易进行。(https://www.daowen.com)
烷、嘧啶等,在这些溶剂中,除极少数特别稳定的酶如枯草杆菌蛋白酶外,绝大多数酶都会失活。一般认为,酶在疏水性大的介质中反应活性高,因此酶催化反应在非极性(apolar)或与水不混溶的(immiscible with water)疏水性有机溶剂中更易进行。(https://www.daowen.com)
溶剂剥夺酶分子表面结构水的能力取决于溶剂的极性和水含量。有机溶剂的水含量必须调整到酶保持最佳活性所必需的水活度(water-activity,αw)值。用水含量为2.5%的冷冻干燥α-胰凝乳蛋白酶在水含量小于0.02%的不同有机溶剂中震荡1h后,测定酶中剩余水含量及酶催化酯化反应的活性,表明在辛烷中活性最高,随着溶剂极性增大,活性不断下降,最后降到0.004以下(Kcat/Km)。
有些酶在高极性有机溶剂中仍有相当高的活性,实验结果表明酶活性除受溶剂极性和水含量影响外,还与溶剂的介电常数、底物的极性和酶活性中心的亲水性与疏水性有关。酶和底物之间的结合能是酶催化反应的主要推动力,底物必须从反应介质中解析出来与酶活性中心结合。枯草杆菌蛋白酶、α-胰凝乳蛋白酶和很多其他酶的活性中心都是疏水性的,它们与疏水底物反应最有利,因为疏水性底物更容易从水中解析到达疏水性活性中心。然而当有机溶剂替代水后,疏水性底物与有机溶剂间的相互作用增强,底物从溶剂到达活性中心就比在水中困难,从而减慢了酶催化反应的速度。而亲水性底物在疏水性较强的溶剂中则容易进入酶的活性中心,从而加快酶催化反应速度。因此亲水性底物应选择疏水性较强的溶剂,而疏水性底物应选择疏水性弱的溶剂更好。Klibanov在研究枯草杆菌蛋白酶(subtilisin)催化的转酯反应中,发现亲水性底物N-Ac-L-Ser OEt在疏水性溶剂CH2Cl2中反应速度快,而疏水性底物N-Ac-L-PheOEt在亲水性溶剂叔丁醇或叔丁胺中反应速度快。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





