氧化还原酶需要辅酶作为反应过程中氢或电子的传递体。常用辅酶有尼克酰氨腺嘌呤二核苷酸NADH(nicotinamide adenine dinucleotide),又称辅酶I(Co I);尼克酰氨腺嘌呤二核苷酸磷酸NADPH(nicotinamide adenine dinucleotide phosphate),又称辅酶Ⅱ (CoⅡ)。它们是氧化还原酶的主要辅酶。80%的氧化还原酶以NADH作为辅酶,10%的氧化还原酶以NADPH为辅酶。少数氧化还原酶以黄素单核苷酸FMN(flavin mononucleotide)和黄素腺嘌呤二核苷酸FAD(flavin adenine dinucleotide)作为辅酶。辅酶一般不稳定,价格昂贵,而且不能用一般的合成物所代替。
还原反应中产生的氧化态辅酶需要通过另一种还原酶催化再生为还原态,这样能使辅酶保持在催化剂量水平,从而降低成本。辅酶循环效率决定了辅酶被反复使用的次数,它被称为总转换数(total tuenover number,TTN),即每摩尔辅酶用于转化产物的总摩尔数。一般来说,对于实验室规模要求TTN至少为1×103~1×104,而对于工业化生产则需要达到1×105以上。辅酶循环使用是大规模工业化生产的瓶颈因素,多年来人们一直在致力于辅酶循环使用的研究与开发。最近的研究发现,甲基紫精(methyl viologen,联二-N-甲基吡啶)在脱氢酶催化反应体系中能发挥辅酶传递电子的作用,从而为脱氢酶在手性合成中的应用提供了新的辅酶循环再生途径。
氧化型NAD+也可采用化学法还原再生,其中最容易的方法是用连二亚硫酸钠(Na2S2O4)作为还原剂,但这种方法的转换系数很低(TTN≤100),而且酶很容易与连二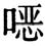 亚硫酸钠反应使酶失活,其作用机理可能是酶蛋白中巯基被氧化修饰。采用电化学或光化学方法也可使辅酶从氧化态再生为还原态,缺点也是转换数低(TTN≤1000),且有副反应。酶催化NAD+或NADP+循环再生则表现出明显的优越性,是当今辅酶循环再生研究中的首选方法。
亚硫酸钠反应使酶失活,其作用机理可能是酶蛋白中巯基被氧化修饰。采用电化学或光化学方法也可使辅酶从氧化态再生为还原态,缺点也是转换数低(TTN≤1000),且有副反应。酶催化NAD+或NADP+循环再生则表现出明显的优越性,是当今辅酶循环再生研究中的首选方法。
4.1.2.1 底物偶联法
底物偶联法是在反应过程中添加辅助底物(供体),在相同酶催化下实现主要底物和辅助底物同时转化,但两者方向相反。为了使反应朝向所需方向进行,一般使辅助性底物过量,以保证转换数TTN>1×103。虽然这种方法原则上适用于氧化反应和还原反应,但主要在还原反应中使用,这是由于脱氢酶催化反应的平衡倾向于还原反应过程。底物偶联再生辅酶循环过程见图4-2。
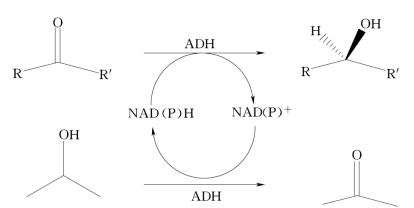
图4-2 底物偶联再生辅酶循环过程
底物偶联的辅酶循环再生系统再生简单,缺点是酶要同时作用于底物和辅助底物,酶催化效率必然降低,有时高浓度辅助底物会抑制酶活性,另外最后还需将产物与辅助底物分离。采用膜反应器系统可克服这些缺点。
4.1.2.2 酶偶联法
酶偶联途径是利用两个平行的氧化还原反应酶系统,一个酶催化底物转化,另一个酶则催化辅酶循环再生。为了达到最佳效果,两个酶的底物应相对独立,以避免两个底物竞争同一酶的活性中心,见图4-3。
1.甲酸脱氢酶
甲酸脱氢酶(formate dehydrogenase,FDH)广泛用于NADH循环再生,它使甲酸氧化生成CO2,同时使氧化态辅酶还原,见图4-3。该方法的最大优点是辅助底物甲酸和反应产物(CO2)对酶无毒和易于除去,FDH稳定性好、易于固定化,且已可商品化供应。该系统的缺点是FDH成本较高,酶的比活性低(3U/mg),这两个缺点都可以用酶的固定化方法或FDH-膜反应器加以解决。总之,甲酸/FDH系统最方便和最经济的NADH再生方法,特别适用于大规模重复性使用,其TTN可达1×103~1×105。从博伊丁假丝酵母(Canidida boidinii)得到的FDH仅适用于NADH的循环再生,最近运用基因工程法从假单胞菌中克隆得到的FDH适用于NADPH的循环再生。有关NADPH循环使用的实验室方法已经建立,但是大规模廉价工业化生产方法还有待研究。
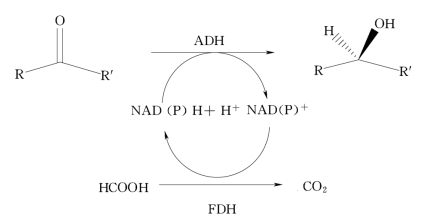
图4-3 酶偶联产生辅酶循环
2.葡萄糖脱氢酶(www.daowen.com)
葡萄糖和葡萄糖脱氢酶(glucose dehydrogenase,GDH)系统是另一种NADH或NADPH再生系统。由于葡萄糖的氧化产物葡萄糖酸内酯会自发转变为葡萄糖酸,因而反应朝着有利于NAD(P)H生成的方向进行。蜡状芽孢杆菌(Bacillus cereus)葡萄糖脱氢酶稳定性好,并且对NAD+或NADP+都有很高的比活性,该方法的缺点是GDH价格昂贵,并且产物与葡萄糖酸分离困难,如果没有分离问题,这是一个很有价值的NADPH再生方法。
6-磷酸葡萄糖脱氢酶(G6PDH)可将6-磷酸葡萄糖(G-6-P)氧化为6-磷酸葡萄糖酸内酯,后者再自发转变为6-磷酸葡萄糖酸,并产生NADPH。因此,这也是一个很好的NADPH再生系统(见图4-4)。肠系膜状明串珠菌的G6PDH价格便宜、稳定,适用于NAD+和NADP+的循环再生。而酵母菌G6PDH仅适用于NADP+循环再生。G-6-P价格昂贵,大量使用时须用己糖激酶催化葡萄糖生成G-6-P,且该反应还涉及到ATP再生问题。然而酿酒酵母的G6PDH和6-硫酸葡萄糖可用于NADPH循环再生,葡萄糖硫酸盐比葡萄糖磷酸盐容易制备。
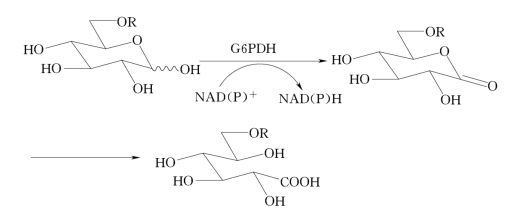
图4-4 NADPH再生系统
3.醇脱氢酶
乙醇-醇脱氢酶(alcohol dehydrogenase,ADH)系统已被用于NADH和NADPH的循环再生。ADH价格适中,乙醇与乙醛具有挥发性,这是该系统的优点。酵母ADH可使NAD+还原,肠系膜状明串珠菌ADH能使NADP+还原。由于ADH氧化还原能力低,只有活化的羰基底物(如醛和环酮类),才能被有效地还原。对于其他类型底物,只有用过量乙醇或除去反应中生成的乙醛,才能促进反应朝向NAD(P)H生成方向进行。乙醛可以通过向反应体系中通入氮气而除去,或用醛脱氢酶将乙醛氧化为乙酸,同时还会产生另一分子的还原型辅酶。该方法的缺点是若不及时除去乙醇和乙醛,会抑制酶的活性。
4.氢化酶
氢化酶(hydrogenase)能催化NADH再生,这种酶以分子氢直接作为氢的供体,氢有很强的还原能力,同时对酶和辅酶无毒。该系统无副产物生成,具有很好的应用前景。但目前氢化酶需要通过复杂的发酵途径才能获取,尚无商品化供应,另外氢化酶对氧化特别敏感。
5.谷氨酸脱氢酶、乳酸脱氢酶
氧化还原反应中有时需要氧化态NAD(P)+的再生,谷氨酸脱氢酶(glutamate dehydrogenase,GluDH)能将α-酮戊二酸还原生成L-谷氨酸,同时使氧化态NAD(P)+得到再生。此外,α-酮己二酸可代替α-酮戊二酸生成有用的产物Lα-氨基己二酸。丙酮酸-乳酸脱氢酶(LDH)系统也可用于NAD+循环再生。该系统的优点是酶比活性高、酶源廉价。缺点是酶的氧化还原能力低和NADP+不能作为其辅酶。另外,乙醛-酵母ADH系统也可用于NAD+的再生,其转换数达到1×103~1×104。该系统中酶容易失活是其致命的弱点。
4.1.2.3 人工电子传递体
利用完整细胞还原体系进行辅酶循环再生,比游离酶还原体系具有优势。然而微生物还原反应中的最终氧化还原体系是碳水化合物,这些化合物会被细胞代谢,仅有少数能作为氧化还原体,因此该过程效率不高,且有副反应。不能降解的有机分子如甲基紫精(methyl viologen)可用于氧化还原反应中的电子传递体,将电子从供体转移给氧化态辅酶。该方法的缺点是所用电子传递体常为染料类有机分子,有些染料分子对细胞具有一定的毒性。
人工电子传递体的还原态可以直接或间接地再生NADH,而传递体的氧化态可被廉价的还原剂(如氢、甲酸、一氧化碳等)经生物催化再生。催化这些反应的氧化还原酶包括氢化酶、甲酸脱氢酶和一氧化碳脱氢酶等。这些酶往往和烯酸还原酶存在于同一微生物内,因此烯酸还原酶和辅酶循环再生系统能有机地结合起来。另外,电化学电池阴极上的电子也可用于染料中间体的还原,这种非酶催化反应过程很容易通过氢或一氧化碳的消耗或者电流的变化来监控。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




