为了考察ROH·+是否具有损伤蛋白质的潜力,本章研究了ROH·+对色氨酸(Trp),酪氨酸(Tyr),L-半胱氨酸(Cys)和溶菌酶的反应活性。
在pH=7.4和O2饱和的条件下,355nm激光闪光光解ROH和Trp的微乳体系所得到的动力学衰减曲线表明,Trp的存在能够加快ROH·+在590nm处的动力学衰减(图4-16A),说明ROH·+能够和Trp发生反应。同样,将Trp浓度值与对应Trp浓度下ROH·+在590nm处的kobs按照公式(2-13)进行线性拟合(图4-16插图),本章计算出它们之间的反应速率常数(表4-1)。但是,在pH=7.4和O2饱和的条件下,355nm激光闪光光解ROH和Trp的微乳体系所得到的不同时刻的瞬态吸收谱图上很难找到Trp·(λmax=530nm[136,137])的瞬态吸收(图4-16B),因此,无法判断ROH·+和Trp之间的反应类型。
在pH=7.4和O2饱和的条件下,355nm激光闪光光解ROH和Cys的微乳体系所得到的瞬态吸收谱图表明,随着ROH·+的特征吸收峰的衰减,在380nm处出现一个新的瞬态吸收峰(图4-17A),590nm处的衰减过程与380nm处的生成过程几乎是同步的(图4-17B),因此得出ROH·+与Cys发生了反应,生成了在380nm具有吸收的瞬态物质。对380nm处瞬态产物的归属是非常困难的,一方面,如果ROH·+与Cys发生了电子转移反应,所生成的巯基阳离子自由基(R-S·+)能够与邻近的S,O或者N上的未成键电子对络合,形成相应的含硫三电子键自由基(λmax=380nm)[156-158];另一方面,由于ROH·+与NaN3和卤族阴离子的加成产物的特征吸收均是在370~390nm之间,因此,380nm处的瞬态产物也有可能是ROH·+与Cys之间的加成产物。
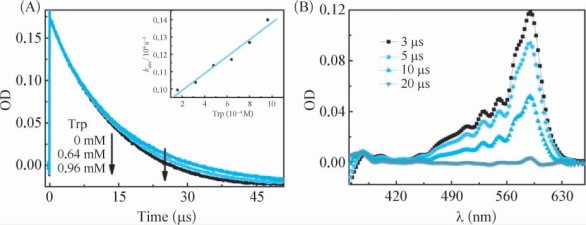
图4-16 (A)在pH=7.4条件下,355nm激光闪光光解ROH(0.05mM)和不同浓度Trp的微乳体系所得到的ROH·+在590nm的动力学衰减曲线。插图:ROH·+在590nm的kobs与相应Trp浓度值之间的线性拟合。(B)在pH=7.4和O2饱和的条件下,355nm激光闪光光解ROH(0.05mM)和Trp(0.96mM)的微乳体系后在3μs( ),5μs(
),5μs( ),10μs(
),10μs( )和20μs(
)和20μs( )的瞬态吸收谱图(www.daowen.com)
)的瞬态吸收谱图(www.daowen.com)
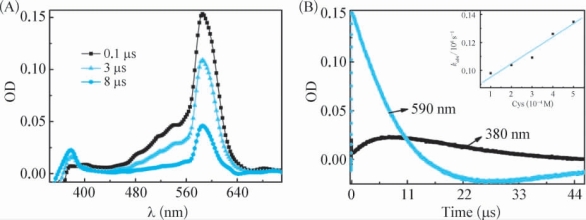
图4-17 (A)在pH=7.4和O2饱和的条件下,355nm激光闪光光解ROH(0.06mM)和Cys(10mM)的微乳体系后分别在0.1μs( ),3μs(
),3μs( )和8μs(
)和8μs( )的瞬态吸收谱图。(B)在相同条件下所得到的在380nm和590nm的动力学衰减曲线。插图:在pH=7.4条件下,355nm激光闪光光解ROH(0.05mM)和不同浓度Cys的微乳体系所得到的ROH·+在590nm的kobs与相应Cys浓度值之间的线性拟合
)的瞬态吸收谱图。(B)在相同条件下所得到的在380nm和590nm的动力学衰减曲线。插图:在pH=7.4条件下,355nm激光闪光光解ROH(0.05mM)和不同浓度Cys的微乳体系所得到的ROH·+在590nm的kobs与相应Cys浓度值之间的线性拟合
通过公式(2-13)本文计算出了ROH·+与Cys和Lyso之间的反应速率常数(表4-1),但是无法证明ROH·+能够与Tyr发生反应。同样,本文无法表征ROH·+和Lyso之间的反应机理。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






