色氨酸(Trp)和酪氨酸(Tyr)是许多蛋白质的重要组成部分,蛋白质中这两种氨基酸的残基也是ROS损伤的主要目标[135]。溶菌酶含有3个Tyr残基和6个Trp残基,其中4个Trp残基暴露在溶剂中。许多研究表明,ROS与Lyso的反应是通过与Lyso的Tyr和Trp残基的作用进行的[130-131]。既然Lyso能够与ATRA·+反应,那么ATRA·+也应该与Tyr和Trp反应。为此,本书单独考察了ATRA·+与Tyr和Trp的反应活性。
在pH=7.4和O2饱和的条件下,355nm激光闪光光解ATRA和Trp的微乳体系所得到的动力学衰减曲线表明,Trp的存在能够加快ATRA·+在590nm处的动力学衰减(图3-14),说明ATRA·+和Trp之间发生了反应。所得到的瞬态吸收谱图表明,随着ATRA·+的衰减完成,510nm处能够观察到一个微弱的宽吸收带(图3-14)。Trp·+的pKa约为4.8,因此,在pH=7.4条件下,如果Trp被单电子氧化,所生成的产物应是一个以N为中心的中性自由基(Trp·),Trp·的特征吸收在510nm附近[136,137],因此,推测ATRA·+可能通过电子转移的途径氧化Trp生成Trp·,但是由于在这里Trp·的吸收很弱,即使通过减谱的方法,也很难从动力学衰减曲线上看出其动力学生成过程。
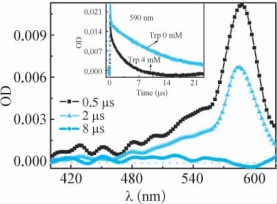
图3-14 在pH=7.4和O2饱和的条件下,355nm激光闪光光解ATRA(0.06mM)和Trp(4mM)的微乳体系后分别在0.5μs( ),2μs(
),2μs( )和8μs(
)和8μs( )时刻的瞬态吸收谱图。插图:ATRA·+在590nm处的动力学衰减受Trp(4mM)的影响
)时刻的瞬态吸收谱图。插图:ATRA·+在590nm处的动力学衰减受Trp(4mM)的影响
与Trp相似,Tyr的加入也能够加快ATRA·+在590nm处的动力学衰减,但是从瞬态吸收谱图上,无法找到酪氨酸中性自由基(Tyr·,λmax=390和410nm)的特征吸收峰[138,139]。通过式(2-13)本文分别计算出了ATRA·+与Trp和Tyr之间的反应速率常数(表3-1),从速率常数的角度看,ATRA·+与Lyso,Trp和Tyr之间的速率常数很接近,这从一定程度上说明了ATRA·+与Lyso的反应可能是通过与Lyso的Tyr和Trp残基作用进行的。
在中性pH值下,Tyr和Trp被单电子氧化或者发生光电离之后,会生成相应的中性自由基:Trp·(λmax=510nm)和Tyr·(λmax=390和410nm)[136-139]。在pH=7.4和O2饱和的条件下,355nm激光闪光光解ATRA和Lyso的微乳体系所得到的不同时刻瞬态吸收谱图上很难找到与Trp·+和Tyr·+相对应的瞬态吸收(图3-15),因此,本文无法判断ATRA·+和Lyso之间的反应是否是电子转移的过程。除此之外,本章得到了半胱氨酸与ATRA·+的反应速度常数(表3-1)。(www.daowen.com)
表3-1 在pH=7.4条件下,ATRA·+与所选物质的反应速率常数(单位:M-1s-1)


图3-15 在pH=7.4和O2饱和的条件下,355nm激光闪光光解ATRA(0.06mM)和Lyso(1.2mM)的微乳体系后分别在0.5μs( ),5μs(
),5μs( 和20μs(
和20μs( )时刻所得的瞬态吸收谱图
)时刻所得的瞬态吸收谱图
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





