实验目的
1.学习和掌握哺乳动物线粒体DNA的提取方法。
2.了解利用线粒体基因组进行分子系统进化研究的原理和分析方法。
3.学习构建系统进化树各种软件的使用方法。
实验原理
作为遗传物质的DNA同时也是生物进化史的重要记录者,在研究生物的进化过程、确定物种间的进化关系方面具有信息量大、易于分析以及容易获取的优势。线粒体DNA(mitochondrial DNA,mtDNA)是高等动物唯一的核外遗传物质,呈共价闭合的环状双链结构。与核基因组相比,线粒体基因组具有结构简单、进化速度快(是单拷贝核基因的5~10倍)、呈严格的母性遗传、遗传行为相对独立、变异发生的几率相对稳定、无组织特异性以及提取方便等独特的遗传特性,已被广泛地应用于物种起源与进化、生物分类以及群体遗传结构等方面的研究。在进化分析时,研究者往往选择不同的区域进行不同时间尺度的进化分析。其中线粒体控制区(D-loop)为非编码区,因缺乏编码的选择压力,是mtDNA中进化最快、变化最复杂的区域,常用于种内或种间遗传进化研究。而细胞色素b 基因(Cyt b)的结构和功能在mtDNA的13个蛋白质编码基因中被研究得最为清楚。细胞色素b 基因变异适中,含有准确的系统发育信息,是系统进化和种群遗传研究中的理想标记基因,在近缘物种和快速形成的物种间系统进化关系研究以及种群研究等方面已有广泛应用。
哺乳动物的系统进化和分类研究一直是生命科学研究的热点之一。本实验以模式动物小鼠为研究对象,提取小鼠肝脏的线粒体DNA。针对小鼠线粒体基因组D环的部分序列和细胞色素b基因的全序列设计合成特异引物进行PCR扩增,检测后进行测序。用Blast与GenBank中啮齿类其他常用实验动物的线粒体基因进行同源序列比较,分析其碱基组成及变异情况,并用邻接法、最大简约法、最小进化法构建分子系统树,在分子水平上探讨小鼠和常用啮齿类实验动物的进化关系。
实验用品
1.材料
小鼠(Mus musculus)。
2.试剂
(1)匀浆液:0.25mol/L蔗糖,10mmol/LNa2EDTA,30mmol/LTris-HCI,2.5mmol/LCaCl2,pH8.2。
(2)溶液Ⅰ:10mmol/LTris-HCl,10mmol/LNa2EDTA,0.15mmol/LNaCl,pH8.0。
(3)溶液Ⅱ:1%SDS,含0.2mmol/LNaOH(现配现用)。
(4)溶液Ⅲ:KAc溶液(含3mol/LK+,5mol/LAc-)。
(5)酚-氯仿-异戊醇=24∶24∶1。
(6)无水乙醇,75%乙醇,TE。
(7)10×PCR buffer(含Mg2+20mmol/L)。
(8)10mmol/LdNTP。
(9)2U/μLTaq DNA聚合酶。
(10)10 pmol/μL上下游引物。
(11)DNA模板,ddH2O。
(12)小鼠线粒体D-loop 序列扩增引物
P1:5′-ATA AAC ATT ACT CTG GTc TTG TAA ACC-3′
P2:5′-ATT AAT TTA AAG GCC AGG ACC AAA CCT-3′
(13)哺乳动物cyt b 扩增通用引物
L14724:5′-CGA AGC TTG ATA TGA AAA ACC ATC GTT G-3′
H15149:5′-AAA CTG CAG CCC CTC AGA ATG ATA TTT GTC TCA-3′
3.器具
电动匀浆器、高速冷冻离心机、制冰机、电子天平、电冰箱、PCR仪、电泳仪、电泳槽、凝胶成像系统、10mL离心管、微量移液器、无菌枪头、无菌离心管(2mL,0.2mL)、离心管盒、冰盒、枪头盒等。
实验操作程序
1.mtDNA提取
采用王文和施立明(1993)碱变性法,略有改动。
(1)取2g冻存的小鼠肝组织和10mL匀浆液加入电动匀浆器,1 500r/min匀浆10次。
(2)匀浆物转入10mL离心管中,于4℃、1 500r/min离心10min。
(3)取上清液于2mL离心管中,4℃、15 000r/min离心20min,弃上清液,收集的沉淀即为线粒体。
(4)沉淀中加入2mL匀浆液,混匀,4℃、15 000r/min离心10min,弃上清。
(5)加入150μL溶液Ⅰ,轻轻吹打,混匀后加入300μL新配制的溶液Ⅱ,轻轻混匀。
(6)放冰浴中10min,再加225μL溶液Ⅲ,混匀后继续冰浴1h。
(7)4℃、12 000r/min离心10min,取上清。
(8)加入等体积的酚-氯仿-异戊醇抽提后,吸取上清。(https://www.daowen.com)
(9)加2倍体积无水乙醇,-20℃放置1h。
(10)4℃、12 000r/min离心15min。
(11)沉淀用75%乙醇洗涤,干燥。
(12)加入100μLTE溶解,4℃或-20℃保存待用。
如果用试剂盒提取mtDNA,其操作程序按试剂盒说明书进行。
2.PCR扩增
(1)PCR反应体系(25μL)
DNA模板1μL
10×PCR buffer(含Mg2+20mmol/L)2.5μL
dNTP(10mmol/L)0.5μL
上下游引物(10 pmol/μL)各1μL
Taq DNA聚合酶(2 U/μL)0.5μL
ddH2O补足25μL(2)PCR扩增程序
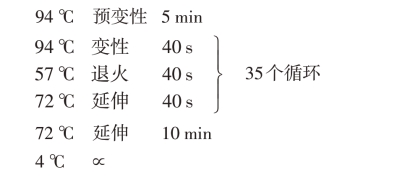
3.电泳检测并测序
扩增得到的PCR产物用1.0%的琼脂糖凝胶电泳检测,用DNA胶回收试剂盒(TaKaRa)进行纯化、回收,对扩增效果良好的样品送往上海生工生物工程有限公司进行双向测定。
4.序列鉴定和分析
将测序结果与GenBank中金黄地鼠(AM904614)、小鼠(EF108339)、豚鼠(AJ222767)、Wistar大鼠(AC000022)、台湾田鼠(NC003041)、南方田鼠(NC008064)和犬(NC002008)的同源序列进行排序。用DNAStar软件包中的MegAlign 程序排列DNA同源序列,并经人工仔细核查,计算不同序列间的核苷酸同源性和碱基组成频率;用MEGA 4.1软件统计物种间遗传距离,基于Kimura 2-parameter双参数模型,采用邻接法(neighbor-joining,NJ)、最小进化法(minimum evolution,ME)和最大简约法(maximum parsimony,MP)进行系统重建,系统树各分枝的置信度由重抽样法(bootstrap)1 000次重复检测。
预期实验结果与分析
1.鼠科动物线粒体D-loop区和Cytb基因碱基长度和组成分析(表26-1)。
2.鼠科动物的遗传距离和遗传相似度
用DNAStar的MegAlign程序分别计算鼠科不同动物控制区和细胞色素b基因的遗传相似度(percent similarity),用MEGA4.1软件Kimura双参数模型计算控制区和细胞色素b基因的遗传距离(geneticdistance),结果见表26-2。
表26-1 鼠科动物的Cytb基因和D-loop基因的序列长度和组成差异

表26-2 鼠科动物D-loop基因和Cytb 基因的遗传相似度(对角线上)和遗传距离(对角线下)(%)

3.进化分析
应用MEGA 4.1软件,以犬为外群,采用邻接法、最小进化法和最大简约法构建系统进化树。
要点及注意事项
1.本实验亦可使用小鼠总DNA提取直接扩增特异片段。小鼠基因组DNA提取可采用常规的酚-氯仿抽提法。
2.进行序列比对时,只取相互对应的序列,忽略长短不一、没有对应关系的序列。
作业与思考题
1.线粒体控制区的突变率约为核DNA的10倍,产生这种高突变率的原因是什么?
2.利用线粒体控制区和蛋白质编码区的基因作为系统进化的研究对象,应用上是否有所区别?试描述之。
参考文献
1.乔守怡.遗传学分析实验教程[M].北京:高等教育出版社,2008.
2.宋国华.中国地鼠线粒体D-loop基因的克隆及序列分析[J].中国畜牧兽医,2013,40(2):126-129.
3.宋国华.中国地鼠线粒体Cyt b基因测序及其分子进化[J].中国实验动物学报,2008,16(2):142-147.
4.王文,施立明.一种改进的线粒体DNA提取方法[J].动物学研究,1993,14(2):197-198.
(孙英莉)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






