实验目的
1.了解DNA指纹分析技术的原理和应用。
2.熟悉可变数目串联重复序列(VNTR)和短串联重复序列(STR)多态性的含义。
3.掌握可变数目串联重复序列和短串联重复序列多态性的检测和分析方法。
实验原理
遗传标记在遗传学的建立和发展过程中有着举足轻重的作用,随着遗传学的进一步发展和分子生物学的异军突起,遗传标记先后相应地经历了形态标记、细胞学标记、生化标记和DNA分子标记四个发展阶段。DNA分子标记本质上是指能反映生物个体或种群间基因组中某种差异的特异性DNA片段。DNA分子标记大多以电泳谱带的形式表现生物个体之间的DNA差异,通常也称为DNA的指纹图谱。产生DNA指纹图谱的过程叫作DNA指纹分析。DNA指纹技术的发展日新月异,第一代的分子标记是以Southern 杂交为基础的限制性片段长度多态(restriction fragment length polymorphism,RFLP),第二代分子标记是以PCR 为基础的各种DNA指纹标记,如RAPD、AFLP、短串联重复序列(short tandem repeats,STR)和可变数目的重复序列(variable number of tandem repeat,VNTR),第三代分子标记是以单核苷酸多态性为基础的SNP。一种理想的分子标记应具有以下特点:多态性高,重复性和稳定性好,带型清晰,容易统计,在染色体上均匀分布,共显性,简单快速,易自动化,开发和使用成本低廉等。
人类基因组DNA中存在一类串联重复序列,其核心序列的长度为10~70 bp,该串联重复单位(核心序列)数目在人群中存在较大差异,具有高度多态性,称为可变数目串联重复序列(VNTR)或小卫星(mini-satellite)DNA。短串联重复序列(STR)形成多态性的原理与VNTR基本相同。STR的核心序列短,为2~7bp,片段长度为100~500bp。STR位点广泛地分布在人类基因组中。据估计,在人类基因组中,每20kb就有一个包含3或4个核苷酸重复序列的STR位点。因STR具有高度多态性及遗传稳定性,已逐渐取代RFLP、VNTR而被广泛应用于遗传疾病的诊断和法医学个人识别。
本实验选择人类基因组中的三个VNTR基因座(D1S80,D17S30和ApoB3′)和21号染色体上的四个STR基因座(D21S11,D21S1432,D21S2054和D21S1446)作为研究对象,通过对人基因组DNA的提取、多态性片段的PCR扩增以及电泳检测,了解串联重复序列多态性的含义和原理,掌握其检测和分析方法。
实验用品
1.材料
参试者口腔上皮细胞或全血。
2.试剂
(1)口腔上皮细胞DNA提取
①0.4%生理盐水。
②裂解液:25mmol/LNaOH,0.2mmol/LEDTA(乙二胺四乙酸)。
③Tris-HCl(40mmol/L,pH5.0)。
④无水乙醇。
⑤TE:含10mmol/LTris-HCl(pH8.0)和1mmol/LEDTA。
(2)全血DNA提取
5% Chelex100溶液:Chelex 100(Bio-Rad)0.5g,50mmol/LTris-HCl 10mL,用4mol/LNaOH调pH至11.0,室温可保存3个月,使用前充分混匀。
(3)PCR试剂
2×Taq PCR Master Mix,ddH2O,上下游引物,模板DNA。
(4)电泳检测试剂
①2.0%琼脂糖凝胶:称取2.0g琼脂糖放入250mL三角烧瓶,加入1×TAE溶液100mL微波炉加热溶解,冷却至60℃左右加入终浓度为1μg/mL溴化乙锭(EB),缓慢混匀后倒胶板。
②10×TAE电泳缓冲液:Tris 48.4g,冰醋酸11.42mL,0.5mol/LEDTA(pH8.0)20mL,蒸馏水定容至1 000mL,室温保存。
③0.5mol/LEDTA(pH8.0):Na2 EDTA 18.61g,NaOH 2.0g,蒸馏水定容至100mL。
④溴化乙锭(EB):用无菌水配制5mg/mL储藏液,工作浓度1μg/mL。
⑤10×上样缓冲液(Loadingdye):溴酚蓝0.25g,二甲苯腈蓝0.25g,蔗糖50.0g(或甘油50mL),用无菌水60mL(用甘油时49mL)溶解上述试剂,定至100mL,室温保存。
⑥0.16mol/L硝酸溶液。
⑦10mmol/L硝酸银溶液。
⑧0.28mol/L碳酸钠溶液。
⑨1.67mol/L乙酸。
⑩聚丙烯酰胺,DNA相对分子质量标记。
3.器具
微量移液器、高速冷冻离心机、恒温水浴锅、旋涡振荡器、PCR 扩增仪、电泳仪、电泳槽、凝胶成像系统、冰箱、制冰机、无菌枪头、无菌离心管(1.5mL,0.5mL)、无菌棉签、离心管盒、枪头盒、纸杯等。
实验操作程序
(一)可变数目串联重复序列(VNTR)
1.基因组DNA的提取
(1)漱口,用无菌棉签刮取口腔脱落上皮细胞。
(2)将富集口腔脱落细胞的口腔拭子放入盛有1mL生理盐水的1.5mL离心管中。
(3)将拭子置于振荡器上,振荡1min左右,小心地取出棉签,再用适量的生理盐水冲洗。
(4)13 000r/min离心1min,小心地将多余的上清液全部取走,沉淀物即为脱落上皮细胞。
(5)在沉淀中加入25~50μL裂解液,振荡10 s。
(6)98℃孵育20min,振荡后加入等体积Tris-HCl(40mmol/L,pH5.0)。
(7)13 000r/min离心10min,取上清液。
(8)加入无水乙醇,-20℃放置15min。
(9)13 000r/min离心15min。
(10)弃上清,晾干后即得到口腔脱落上皮细胞DNA。
(11)加入适量TE溶解DNA,4℃或-20℃保存待用。
为提高DNA的产率和纯度,可选用TIANamp Swab DNAKit(口腔拭子基因组DNA提取试剂盒,离心柱型,目录号:DP322)。
2.PCR扩增
3个VNTR基因座的引物序列和PCR扩增体系及扩增参数分别见表24-1和表24-2。
表24-1 3个VNTR基因座的引物序列及PCR条件

表24-2 3个VNTR位点PCR扩增体系

3.电泳与检测
采用2%琼脂糖凝胶60V电泳,30~40min后取出凝胶用清水漂洗5~10min。凝胶成像系统观察和记录每个个体的DNA条带数目及其位置。
4.数据记录与分析
读取各个体样本的基因型,计算基因型频率及等位基因频率,用χ2检验进行Hardy-Weinberg平衡吻合度检验(表24-3)。
表24-3 3个VNTR位点基因频率和基因型频率的分布
 (https://www.daowen.com)
(https://www.daowen.com)
(二)短串联重复序列(STR)
1.基因组DNA的提取
(1)取3~10μL全血加入1.5mL离心管中,再加入500μL纯水,剧烈振荡,室温下放置15min。
(2)13 000r/min离心3min,弃上清,收集沉淀。(必要时可用蒸馏水反复清洗沉淀物,直至无色或血色素很少)。
(3)沉淀中加入200μL5%Chelex-100溶液(5%Chelex-100为悬浊液,使用前要充分振摇,使Chelex-100颗粒悬浮),在振荡器上反复振荡后,放入56℃水浴保温30min以上。
(4)取出后振荡,100℃保温8min,再振荡后,13 000r/min离心3min,上清用于PCR扩增,或放4℃保存备用。(此DNA样本可在4℃或-20℃保存,必要时在使用前再次加热并离心,使管内物质分层)
2.位点选择及其特性(表24-4)
表24-4 4个21号染色体STR位点的基本参数

3.PCR扩增
4个STR基因座的引物序列和PCR扩增体系及扩增参数分别见表24-5和表24-6。
表24-5 4个STR基因座的引物序列及PCR条件

表24-6 4个21号染色体STR位点PCR扩增体系

4.变性凝胶电泳
取扩增产物2.0μL与2.0μL变性加样缓冲液混合均匀,95℃变性2min,立即置于冰浴,采用6%变性聚丙烯酰胺凝胶垂直电泳,先预电泳1h,上样后恒功率40W,电泳3h。完毕后将凝胶取下,用双蒸水冲洗1次,置于0.16mol/L硝酸溶液中,轻摇反应10min,双蒸水冲洗,再置于10mmol/L硝酸银溶液中,轻摇反应20min,双蒸水冲洗,然后置于0.28mol/L碳酸钠溶液中,轻摇反应,至条带清晰后加入1.67mol/L乙酸终止反应并固定显色。
5.DNA序列的测定
挑选每个STR位点中至少2个以上不同片段长度的纯合子样本,经PCR扩增及纯化试剂盒纯化后进行DNA序列测定,根据测序结果推测其余不同片段长度等位基因的重复数。
6.统计学分析
运用直接计数法观察位点的基因频率,通过PowerStats软件进行数据统计分析,计算杂合度(heterozygosity,H)、多态信息量(polymorphism informationcontent,PIC)及个体识别率(average power ofdiscrimination,PD)。用χ2进行Hardy-Weinberg平衡吻合度检验(表24-7)。
表24-7 4个STR基因座的等位基因频率和群体遗传学参数

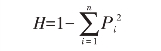
其中:n为等位基因的数目;Pi为等位基因的频率。
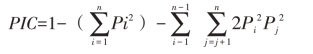
其中:n为等位基因的数目;Pi为第一个等位基因在群体中的频率。
预期实验结果与分析
1.VNTR基因座
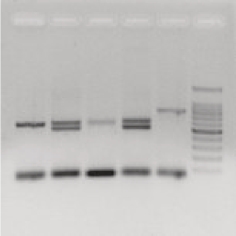
图24-1 D1S80的PCR扩增产物检测结果
人群中D1S80座位核心序列是16bp,重复数目一般在14~41之间。理论上讲,可能存在435种不同的等位基因组合。D17S30是位于人类第17号染色体短臂上的(17pl3.3)以70bp为核心单元的VNTR位点。目前共发现17种等位基因,片段长度在168~1148bp之间,具有高度多态性。ApoB3′位于第2号染色体短臂末端,不同地域、不同种族人群,PCR扩增产物包含重复序列的拷贝数也不同,目前共发现超过15种以上等位基因,每个重复序列富含碱基A和T,长约14~16bp。重复序列是以X、Y及其变异体为重复单位组成的串联结构,X的基本序列为ATAATTAAATTTT,Y的基本序列为ATAATTAAAATATTT。X与Y的差异仅在于第10~12位核苷酸。利用不同VNTR座位两侧序列设计的引物,通过PCR反应,很容易确定特定个体的VNTR座位等位基因构成,纯合体只有一条DNA带,而杂合体有两条不同的DNA带(图24-1)。最前端条带为过剩引物二聚体。
2.STR基因座
21号染色体是人类染色体中最小的一条近端部着丝粒染色体,其上存在多态性遗传标记,STR是其中之一,具有以下特点:
(1)在正常人群中有多态性,即STR拷贝数在人群中是可变的。
(2)具有遗传连锁不平衡现象。
(3)STR均可被转录,有些与蛋白质编码基因有关,有些与蛋白质编码基因无关,利用这一特点可对STR进行命名。
(4)属于不稳定的DNA序列,其数目在某些遗传病有扩增现象,这种扩增不是减数分裂重组造成的,扩增可以发生在减数分裂过程中,也可以发生在有丝分裂过程中,从而导致嵌合体形成。与成熟人体细胞比较,STR在胚胎时期有丝分裂很不稳定。
(5)不同基因位点上的STR重复序列可以不同,也可相同。
遗传标记的多态性及其应用价值一般可用H、PIC、PD及P值来衡量。H能客观地反映样本的遗传变异水平,平均H越大,表明群体内遗传差异越大,多态性越高,PIC则直接反映出遗传标记所包含或所能提供的遗传信息总量,PIC>0.5时,说明该遗传标记具有高度的可提供信息性,PD则反映了该遗传标记在法医学个体识别及亲权鉴定中的能力,一般认为PD>0.8时,该遗传标记具有高度多态性,有较高的应用价值。
要点及注意事项
1.VNTR位点扩增产物为杂合子时,两条带的产量往往有差异,短片段产量较长片段高,随着两片段长度相差越大越明显,这是由于小基因较大基因更容易扩增,以致将杂合子误判为纯合子。当DNA部分降解,尤其长片段的靶DNA降解时,只扩增出短片段,导致错误判型,限制了VNTR系统的应用。
2.STR系统检测方法灵敏度极高(ng量DNA即可测出),当样品中掺入其他微量DNA时,可导致错误判型。
3.进行PCR时,按要求添加模板DNA。太少可能得不到扩增产物,太多特异性会降低。
4.Chelex-100沉降很快,使用时需要不停地搅拌。
5.Chelex-100快速抽提的DNA最好马上PCR,因这种方法获得的DNA不够稳定。
6.溴化乙锭为诱变剂,有致癌作用。配制、稀释和染色时必须戴手套。
作业与思考题
1.描述DNA分子标记的发展史,列举常用分子标记类型及其应用。
2.简述VNTR和STR在结构、检测方法及其应用上的异同点。
3.提取人类全基因组DNA的方法有很多,列举常用的提取方法,并指出每种方法的优势和劣势。
参考文献
1.乔守怡.遗传学分析实验教程[M].北京:高等教育出版社,2008.
2.周洲,程罗根.遗传学实验[M].北京:科学出版社,2013.
3.张根发.遗传学实验[M].北京:北京师范大学出版社,2010.
4.张文霞,戴灼华.遗传学实验指导[M].北京:高等教育出版社,2007.
5.李小明等.VNTR遗传标记的亲权鉴定研究[J].中国法医学杂志,1996(4):195-199.
6.邬晋芳等.21号染色体上STR位点的遗传多态性研究[J].中国妇幼健康研究,2009,20(1):21-23.
7.徐振波等.DNA分析技术在法科学中的应用及展望[J].法律与医学杂志,2000(2):80-84.
(孙英莉)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。








