实验目的
1.了解拟南芥T-DNA插入纯合突变体鉴定的基本原理与方法。
3.学习确定T-DNA插入突变基因与突变体表型直接关联的方法。
4.了解RNAi技术的原理及其在植物基因功能分析中的作用。
实验原理
突变体分析一般包括T-DNA插入纯(杂)合突变体鉴定、突变基因分析(利用突变体或可能根据需要使用RNAi技术)、基因功能互补分析等。T-DNA插入纯合突变体鉴定一般采用三引物PCR法,即以拟南芥突变体植株的基因组DNA为模板进行PCR扩增。其中所用引物LP和RP是根据T-DNA插入序列的左边界和右边界序列设计,可以扩增TDNA插入前野生型序列片段,LBa1是根据靠近RP(或LP)插入位点区域的T-DNA序列设计的引物。当用三种引物同时进行PCR扩增时,野生型只能扩增出LP和RP之间区域,片段较长;纯合子突变体只能扩增出LBa1和RP(或LP)之间区域,片段较短,而杂合子则能同时扩增出上述两条大小不同的片段,通过凝胶电泳很容易区分出来。纯合子突变体筛选出来后采集到的子代都可稳定遗传,是用于后续突变体基因功能研究的直接材料。
突变体基因功能的研究必然涉及基因的表达。提取总RNA是基因表达研究的第一步。植物RNA的提取方法有多种,这里主要介绍最常用的Trizol法。Trizol的主要成分是酚和可以抑制RNA酶的胍盐,它可以破坏细胞内蛋白,使核酸释放出来的同时保护其完整性。加入氯仿后使蛋白变性,离心所得样品分成水样层和有机层。RNA存在于水样层中。收集上面的的水样层后,RNA可以通过异丙醇沉淀来还原。当得到纯度好的植物总RNA后就可以进行反转录PCR(RT-PCR)。
(一)反转录PCR
提取组织或细胞中的总RNA,以其中的mRNA作为模板,采用Oligo(dT)或随机引物利用反转录酶反转录成cDNA。再以cDNA为模板进行PCR扩增,从而获得目的基因或检测基因的表达。在扩增目的基因片段的同时还需扩增内参基因(如ACTIN2)作为对照,可以得到目的基因的相对表达量。
(二)基因功能互补实验
T-DNA插入植物基因组后可能造成目的基因功能部分或完全丧失,从而使突变体也相应表现出一些不同于野生型的表型。当外源目的基因通过转基因技术在突变体中得以表达时,就会部分或完全补偿原有目的基因所丧失的功能,也能部分或全部恢复原有野生型的表型,这也从另一方面证实T-DNA插入造成的目的基因功能改变与突变体表型直接相关。其中构建携带目的基因片段的载体是关键,这些双元载体经过研究人员的改造已经形成一套完整的用于表达、定位、标记等研究的载体库,如pCAMBIA系列等。这些载体中常会携带花椰菜叶病毒(CaMV)35S启动子,它可以介导外源基因在拟南芥体内组成型表达,也可以根据需要选用不同的特异性表达的启动子(如目的基因原有的启动子)。完成质粒构建后,在大肠杆菌中扩增并制备质粒,用热融法将载体转入农杆菌GV3101菌株的感受态细胞中。通过抗性筛选已转化的农杆菌阳性克隆,进一步通过PCR或酶切鉴定,将得到的阳性农杆菌克隆在YEB培养基中28℃扩增,通过前面提及的浸染花序法转化拟南芥。同样通过抗性(如潮霉素)筛选得到转化纯合子,其可以表达外源目的基因。将筛选到的转化植株分别进行表型检测和基因表达量检测,就可以得知该转化基因是否可以部分或完全补偿原有目的基因所丧失的功能。
RNAi(RNAinterference)的定义可以分为广义和狭义两种。在植物中,狭义的RNAi特指转基因引入的双链RNA(dsRNA)在体内Dicer酸作用下剪切成21核苷酸长度的双链siRNA,这些siRNA可以特异识别互补的mRNA并降解。广义的RNAi包括长双链dsRNA或茎环前体被处理成21~26核苷酸长度的小RNA,这些小RNA介导互补RNA的剪切、抑制互补RNA翻译或者介导特异目标DNA的甲基化。这些RNAi现象共有三个生化特征:
(1)形成双链RNA(dsRNA);
(2)处理dsRNA,生成21~26核苷酸长度的带突出末端的siRNA;
(3)siRNA与部分或完全互补的RNA或DNA相结合,抑制目的基因的表达。
植物中一般采取构建表达自身互补RNA的载体(如pHELLSGATE等),再通过农杆菌转化的方法导入植物基因组,达到抑制目的基因表达的作用。构建RNAi载体的关键是对插入的序列片段的选择,其与目的片段的同源性是保证RNAi实验成功的关键。如果有突变体和转基因数据相互印证,是确认RNAi 成功的一个好方法。在没有突变体的情况下,需要对一个基因选取多个片段构建RNAi载体,若多个片段的转基因结果一致,则可以说明该表型就是该基因表达下调引起的。
实验用品
1.材料
拟南芥种子、农杆菌菌株GV3101、质粒pBIB-BASTA、pHELLSGATE。
2.试剂
(1)Trizol试剂
(2)SuperscriptTMFirst-Strand Synthesis system 试剂盒(invitrogen)
(3)0.1% DEPC溶液:去离子水加入到RNase-free的玻璃瓶中,加入0.1%(V/V)焦碳酸二乙酯(DEPC)。静置过夜,高压蒸汽灭菌。
(4)异丙醇
(5)10×PCR buffer
(6)dNTPs mixture
(7)25mmol/LMgCl2
(8)Taq 酶
(9)氯仿
(10)无水乙醇
(11)70%乙醇
(12)液氮
(13)ACTIN2引物序列为:
5′-CTAAGCTCTCAAGATCAAAGGCTTA-3′
5′-TTAACATTGCAAAGAGTTTCAAGGT-3′
3.器具
冷冻高速离心机、蛋白核酸分析仪、PCR仪、凝胶成像仪、电泳仪、电泳槽、水浴锅、制冰机、高压灭菌锅、移液枪、1.5mL离心管、PCR反应管、研磨棒、枪头、枪头盒、离心管盒、镊子、一次性手套等。
实验操作程序
(一)拟南芥T-DNA插入纯合突变体鉴定
1.PCR反应分别按如下加样体系进行(20μL):
10×PCR buffer 2μL
25mmol/LMgCl2 1.6μL
dNTPs mixture(10mmol/L) 0.4μL
primer LP、RP、Lba1 各0.5μL
Taq DNA聚合酶 1U
DNA 1μL
ddH2O 加至20μL
2.PCR反应参数:94℃,1min;44~60℃(根据片段大小和组成),1min;72℃,2min,共30次循环。
3.1%的琼脂糖凝胶,电泳检测记录扩增结果(参照实验十九-Ⅲ中PCR检测方法)。
(二)拟南芥总RNA提取
1.提取过程中所用器具均用0.1%DEPC水浸泡过夜,高压灭菌处理;所用试剂以DEPC水配制,操作过程中使用一次性手套。
2.将新鲜叶片约100mg置于液氮预冷过的1.5mL的离心管中,用研磨棒(同样液氮预冷)迅速捣碎成粉末,然后加入1mLTrizol试剂(提前放置在4℃)。振荡,充分混匀后,冰浴静置15min。
3.加入200μL预冷的氯仿,振荡混匀,冰浴静置5min。4℃,12 000r/min离心15min。
4.吸取上清,加入0.7体积预冷的异丙醇,轻轻颠倒混匀,4℃静置15min。4℃,12 000r/min离心10min。
5.弃去上清,加入1mL预冷的无水乙醇洗涤沉淀。4℃,7 500r/min离心5min。
6.弃去上清,加入1mL预冷的70%的乙醇洗涤沉淀。4℃,7 500r/min离心5min。
7.弃去上清,将沉淀干燥5min,加入30~40μLDEPC水溶解沉淀。-20℃保存。
8.用蛋白核酸定量仪测定RNA的纯度与浓度。
(三)反转录合成cDNA(RT)
根据SuperscriptTMFirst-Strand Synthesis system试剂盒(invitrogen)说明过程如下:
1.取一无菌离心管,依次加入3μg总RNA、1μLoligo(dT)和dNTP mix,补加DEPC水至终体积10μL,短暂离心。
2.将反应体系在65℃孵育5min,然后放置冰上1min。(https://www.daowen.com)
3.同时在另一离心管中依次加入如下2×reaction mix。
10×RT buffer 2μL
25mmol/LMgCl 24μL
0.1mol/LDTT 2μL
RNaseOUTTM(40 U/μL) 1μL
4.将上述配制的9μL反应混合液加入步骤2的离心管内,混合均匀,短暂离心。
5.42℃孵育2min。
6.加入1μLSuperscriptTMII RT,42℃孵育50min。
7.70℃下终止反应约15min后用于扩增PCR。
(四)扩增目的基因片段(PCR)
1.PCR反应按如下反应体系加样(50μL):
10×PCR buffer 5μL
50mmol/LMgCl2 1.5μL
10mmol/LdNTP Mix 1μL
Forward Primer(10μmol/L) 1μL
Reverse Primer(10μmol/L) 1μL
Taq(或pfu) 1U
cDNA(RT产物) 2μL
ddH2O 补至50μL
2.按照下述PCR反应程序进行:

3.琼脂糖凝胶电泳检测PCR扩增产物(参照实验十八-Ⅲ中PCR检测方法)。
4.鉴定后需要加大PCR加样体系,最后将产物回收,为后续基因功能互补实验和基因定位实验提供目的基因片段。
(五)基因功能互补实验
1.将筛选得到的转化株、野生型、突变体同时进行表型分析。
2.同时提取上述3种植株RNA,进行RT-PCR检测目的基因表达量变化。
(六)RNAi实验
1.载体构建时所选片段的大小最佳应该在200~600 bp,并通过前文所述PCR方法扩增得到目的片段。
2.对载体和片段进行酶切反应(反应条件根据具体情况可以参考手册)。
一般而言,双酶切加样体系如下(10μL):
酶切缓冲液 1μL
酶Ⅰ 1μL(10 U)
酶Ⅱ 1μL(10 U)
底物DNA 15~17μL(10 ng)
ddH2O 加至10μL
3.将酶切后的片段连接到载体上。
4.将构建的载体转化入大肠杆菌,并在抗性培养基中筛选阳性克隆。
5.提取质粒进行PCR检测目的片段长度。
6.将构建的适合的质粒再转化入农杆菌菌株GV3101,并重复4、5步骤进行鉴定。
7.将适合的携带目的片段质粒的农杆菌转化拟南芥(参照实验十九-Ⅱ中农杆菌转化植物方法)。
8.得到的子代再通过抗性筛选得到转基因植株。
9.可以进行RNAi转基因植株表型观察。
预期实验结果与分析
拟南芥T-DNA插入纯合突变体鉴定:三种引物(LP、RP、LB)鉴定时,只有LP/RP扩增出来的产物是野生型,只有LB/RP扩增出来的是纯合突变体,有两条电泳条带同时扩增出来时是杂合体(图19-Ⅳ-1)。
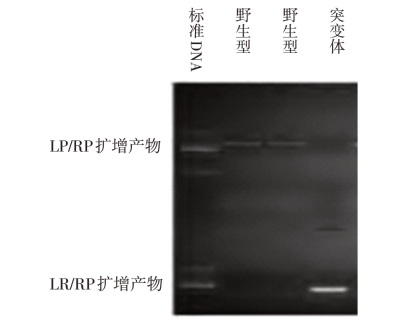
图19-Ⅳ-1 拟南芥T-DNA插入纯合突变体鉴定
(引自张小红等,2013)
RT-PCR检测目的基因表达量:功能缺失突变体中几乎没有目的基因片段的泳带出现,说明突变体中此基因的表达完全被抑制(图19-Ⅳ-2)。
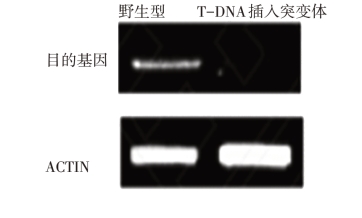
图19-Ⅳ-2 RT-PCR检测目的基因表达量
(引自张小红等,2013)
要点及注意事项
1.总RNA提取时要带一次性手套,离心管等器具要用0.1%DEPC浸泡过夜后,高压蒸汽灭菌,小心晃动及每次转移液体要轻。主要是防止RNAse污染降解RNA和因机械力破坏RNA的完整性。
2.OD260/OD280的比值可以确定样品的纯度,纯的样品OD260/OD280=2.0,如果比值接近2.0,说明RNA的纯度较高,RT-PCR成功的关键就在于高纯度的RNA。
3.扩增目的基因片段,同时需扩增ACTIN2(或其他管家基因)作为内参。
4.必须选用基因特异片段进行RNAi构建。
5.最好基于目的基因取2个片段构建RNAi载体,或者有突变体表型相互对照。
作业与思考题
1.如何防止RNAse污染降解RNA?
2.怎样检验RNA浓度和纯度?
3.如何证实拟南芥T-DNA插入纯合突变体?
4.怎样得到目的基因片段?
5.简述RNAi技术中dsRNA的作用。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。








