实验目的
1.了解和掌握转基因植物鉴定的基本原理和方法。
2.掌握PCR和RT-PCR分子鉴定技术。
实验原理
利用抗生素抗性和除草剂抗性等选择基因排除非转化细胞而留存转化细胞,以及利用Gus和GFP等报告基因显示转基因成功外,在转基因植物的鉴定中,更重要的是从分子水平鉴别出阳性转化体,明确目的基因在转基因植株中的拷贝数和转录与表达情况。因此,根据外源基因表达的不同水平,对转基因植物检测可以分为三个水平:外源基因整合水平、外源基因转录水平和外源基因翻译水平。
外源基因整合水平鉴定的方法有:转基因植物的PCR检测、点杂交和Southern杂交。外源基因转录水平鉴定的方法有Northern杂交和RT-PCR法。外源基因翻译水平鉴定的方法有:Western杂交和ELISA检测等。
本实验中用到的鉴定方法为PCR检测和RT-PCR检测,其中PCR检测是根据外源基因序列设计出一对引物,通过PCR反应便可特异性地扩增出转化植株基因组内外源基因的片段,而非转化植株不被扩增,从而筛选出可能被转化的植株。RT-PCR的原理是在反转录酶作用下,以待检植株的mRNA为模板合成cDNA,再以cDNA为模板扩增出特异的DNA。因此,RT-PCR可在mRNA水平上检测目的基因是否表达。RT-PCR十分灵敏,能够检出低丰度的mRNA,特别是在外源基因以单拷贝方式整合时,其mRNA的检出通常采用RT-PCR法。
实验用品
1.材料
芸芥(Eruca Sativa Mill)、甘蓝(Brassica oleracea)、油菜(Brassica chinensis L.)、小白菜(Brassica campestris ssp.Chinensis)等经发根农杆菌浸染得到的发状根。
2.试剂
(1)0.5mol/LEDTA(pH8.0):在80mL去离子水中加入18.61g二水乙二胺四乙酸(EDTA),搅拌溶解,用NaOH调节pH至8.0,定容至100mL,灭菌。
(2)1mol/LTris-HCl(pH8.0):在160mL去离子水中溶解24.2g Tris 碱,用浓HCl调节pH至8.0,定容至200mL,灭菌。
(3)CTAB提取缓冲液:称取CTAB 4g,NaCl 16.364g,1mol/LTris-HCl 20mL(pH8.0),0.5mol/LEDTA(pH8.0)8mL,先用70mLddH2O溶解,再定容至200mL,灭菌。
(4)0.1% DEPC水:把去离子水加入RNase-free的玻璃瓶中,加入焦碳酸二乙酯(DEPC)至0.1%(V/V)。静置过夜,灭菌。
(5)10×MOPS缓冲液:41.86g MOPS[3-(N-吗啉基)丙磺酸钠盐],4.1g 乙酸钠,溶解于20mL0.5mol/LEDTA(pH8.0),2mol/LNaOH调pH至7.0,去离子水定容至1 000mL。分装后,加入0.1%DEPC,摇床过夜。灭菌。
(6)10mg/mL溴化乙锭(EB)贮备液:称取10mg EB置于离心管中,加入1mL蒸馏水,旋涡混合,直至EB充分溶解,4℃避光保存。
(7)5×TBE缓冲液:54g Tris碱和27.5g硼酸加入约800mL的去离子水中,充分搅拌溶解,再加入20mL0.5mol/LEDTA(pH8.0),搅拌混匀,去离子水定容至1 000mL。
(8)Trizol试剂盒、75%乙醇、异丙醇、氯仿、液氮。
(9)植物DNA提取试剂盒,植物RNA提取试剂盒,PCR试剂盒,RT-PCR试剂盒。
(10)琼脂糖、DNAmarker、甲醛、甲酰胺(去离子)。
(11)无水乙醇、70%乙醇、ddH2O。
(12)相关检测引物
PCR引物序列(rolB):
上游引物pf:5′-ATG GAT CCC AAA TTG CTA TTC CTT CCA CGA-3′
下游引物pr:5′-TTA GGC TTC TTT CTT CAG GTT TAC TGC AGC-3′
RT-PCR引物序列(rolC):
上游引物pf:5′-ATG GCT GAA GAC GAC TTG TGT TC-3′
下游引物pr:5′-CTC GCC ATG CCT CAC CAA CTC-3′
3.器具
PCR 仪、离心机、电泳仪、凝胶成像系统、电子天平、高压灭菌锅、恒温水浴锅、微波炉、制冰机、冰箱、液氮罐、研钵、研磨棒、移液器、镊子、离心管(0.5mL、1.5mL)、PCR管、酒精灯、红黄蓝枪头、离心管盒、枪头盒等。
实验操作程序
(一)PCR 检测转化根
1.DNA提取
CTAB法(十六烷基三甲基溴化铵法)
(1)称取发根0.5g置于研钵中,加入0.4mLCTAB提取液,研磨至匀浆。
(2)将研磨好的溶液移入1.5mL离心管中,放在65℃水浴锅中水浴45min。
(3)加入等体积的氯仿抽提,12 000r/min离心5min。
(4)取上清,加入2倍体积的无水乙醇。
(5)混匀后12 000r/min离心5min。
(6)弃上清,加入70%乙醇洗涤。
(7)12 000r/min离心5min后去除乙醇。
(8)晾干后加入50μLddH2O溶解,-20℃保存备用。
为了提高DNA的产率和纯度,可用植物DNA提取试剂盒,详细操作步骤参考试剂盒使用说明书。
2.DNA琼脂糖凝胶电泳分析
(1)琼脂糖凝胶配制
称取1g琼脂糖,置于干净的三角瓶中,加入100mL1×TBE缓冲液,在沸水浴或微波炉中加热,使之彻底溶解后,加入5μLEB(使之终浓度0.5μg/mL)混匀,配制成1%的琼脂糖溶液。
(2)凝胶板准备
将上述琼脂糖溶液倒入凝胶板模具,静置待其彻底凝固后拔出样品梳。
(3)加样
将凝胶板放置于含1×TBE的电泳槽中,缓冲液要没过凝胶表面。取DNA样品,按体积上样缓冲液∶DNA样品=1∶5的比例加入上样缓冲液,混合均匀后小心地加入凝胶板的加样孔中。按同样方法在附近孔中加入DNAmarker,作为参照。
(4)电泳与观察
以5 V/cm电压开始电泳,当指示剂泳动到距前沿1cm左右时,停止电泳,取出凝胶板,于凝胶成像系统中观察拍照。
3.PCR检测
(1)PCR
反应根据上一步检测的结果,结合PCR试剂盒使用说明书,设定PCR反应体系。通常10μL反应体系如下:
10×PCR buffer 1μL
dNTPs mixture(2.5mmol/L) 1μL
引物(rolB pf和pr) 各0.5μL
Taq DNA聚合酶(5U) 0.25μL
模板DNA 0.5μL
ddH2O 加至10μL(https://www.daowen.com)
扩增参数如下:
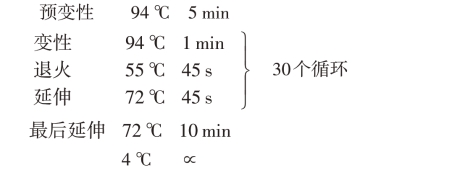
(2)PCR产物检测
将PCR产物按步骤2进行琼脂糖凝胶电泳检测,凝胶成像系统中观察拍照。
(二)RT-PCR检测转化根
1.RNA提取
(1)预先把干净已灭菌的研钵置于冰中预冷。取1.5mL离心管,加液氮预冷。
(2)称取大约50~100mg发根置于研钵中,加液氮研磨成粉末(粉末中无明显的颗粒,如果没有研磨彻底会影响RNA的收率和质量)。
(3)加入1mLTrizol后匀浆,室温放置5min。
(4)加入1/5 Trizol体积量的氯仿(如果加1mL的Trizol则加氯仿200μL)。
(5)盖紧离心管盖,用力振荡,待溶液呈乳白状(无分层相出现)后,在室温静置5min。
(6)4℃,12 000r/min离心15min,小心拿出离心管,将上清转至新的离心管中(切忌吸出白色的中间层)。
(7)向上清中加入等体积的异丙醇,上下颠倒离心管充分混匀后,室温静置10min。
(8)4℃,12 000r/min离心10min。一般在离心后,在试管壁出现沉淀。
(9)小心地弃去上清,缓缓地沿离心管壁加入75%的乙醇1mL(切勿触及沉淀),轻轻上下颠倒洗涤离心管壁。
(10)4℃,12 000r/min,离心5min。
(11)小心弃去乙醇,并尽量去干净乙醇,保留沉淀。
(12)室温干燥2~5min,加入适量的DEPC处理的水(65℃促溶10~15min)。
为提高RNA的产率和纯度,可用植物RNA提取试剂盒,详细操作步骤参考试剂盒使用说明书。
2.RNA检测
提取的RNA需要对其质量和数量进行检测。实验室常用的方法有紫外吸收值检测和电泳检测两种,本实验用电泳检测。
(1)将制胶用具用70%乙醇冲洗一遍,晾干备用。
(2)配制琼脂糖凝胶:称取0.5g琼脂糖,置于干净的烧瓶中,加入40mL蒸馏水,微波炉内加热溶化均匀。
(3)待胶降温至60~70℃时,依次向其中加入9mL甲醛、5mL10×MOPS缓冲液和0.5μL溴化乙锭,混合均匀后立即灌胶(注意避免产生气泡)。
(4)样品制备:取DEPC处理过的500μL小离心管,依次加入10×MOPS缓冲液2μL、甲醛3.5μL、甲酰胺(去离子)10μL、RNA样品4.5μL,混合均匀。
将离心管置于60℃水浴中保温10min,再置于冰上2min;向每管中加入3μL上样染料,混匀。
(5)上样:将制备好的凝胶放入电泳槽中(上样孔一侧靠近阴极),加入电泳缓冲液(1×MOPS缓冲液),液面高出胶面1~2mm,小心拔出梳子使样品孔保持完好。用微量移液器将制备好的样品加入加样孔,每孔上样20~40μL。
(6)电泳:盖上电泳槽,接通电源,样品端接负极,于7.5V/cm的电压下电泳,当溴酚蓝快到达凝胶底部时停止电泳。
(7)检测:电泳结束后,即可在紫外灯下检测结果,完整的总RNA样品应呈现出三条条带,分别为28 S rRNA、18 S rRNA、5 S rRNA。
3.RT-PCR检测
(1)根据上一步检测的结果,结合RT-PCR 试剂盒使用说明书,设定RT-PCR 反应体系,本实验采用Quant一步RT-PCR法。
通常10μL反应体系如下:
10×RT-PCR buffer 1μL
超纯dNTP(10mmol/Leach) 0.5μL
10×RT-PCR enhancer 2μL
RNasin(40 U/μL)0.1μL
Hotmaster Taq polymerase(2.5 U/μL) 0.5μL
Quant RTase(for one step) 0.1μL
引物(rolC pf和pr) 各0.5μL
模板RNA 0.5μL
加RNase-freeddH2O 至10μl扩增参数如下:

(2)RT-PCR产物检测
将RT-PCR产物按实验程序(一)中PCR检测步骤2,进行琼脂糖凝胶电泳检测,在凝胶成像系统中观察拍照。
预期实验结果与分析
得到PCR及RT-PCR检测结果阳性的发状根。PCR及RT-PCR扩增结果如图18-Ⅲ-1所示。转基因芸芥发状根中rol B 基因的PCR 产物大小为750 bp左右,rol C 基因的RTPCR产物大小为500 bp左右。
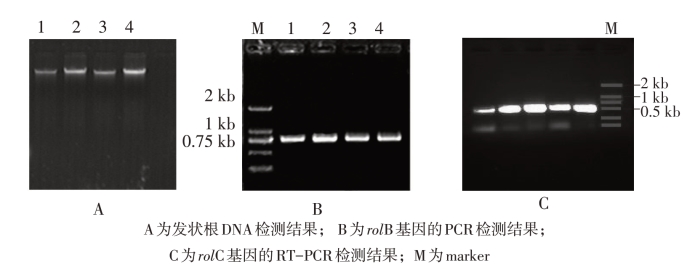
图18-Ⅲ-1 转基因芸芥发状根中rol B和rol C基因检测结果
要点及注意事项
1.使用试剂盒前,仔细阅读试剂盒使用说明书。
2.DNA及RNA提取时应避免剧烈操作。
3.RNA提取时,注意相关试剂使用安全,操作过程中应始终戴一次性橡胶手套,并经常更换,以防止手、臂上的细菌和真菌以及人体自身分泌的RNA酶带到试管或污染用具,尽量避免使用一次性塑料手套。塑料手套不但常常造成操作不便,且塑料手套的多出部分常常在器具的RNase污染处和RNase-free处传递RNase,扩大污染。
作业与思考题
1.了解各种转基因植物分子鉴定的方法及原理。
2.怎么判断所提取的RNA质量?
3.提取的DNA和RNA应该怎么储存?
参考文献
1.马强,徐勤青.转基因植物检测方法的研究与进展[J].种子科技,2009,4:23-25.
2.郭斌,祁洋,尉亚辉.转基因植物检测技术的研究进展[J].中国生物工程杂志,2010,30(2):120-126.
3.刘茵,刘秀花.转基因植物与植物转基因技术简介[J].生物学教学,2004,29(7):3-4.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。








