实验目的
1.了解植物遗传转化的方法和原理。
2.掌握发根农杆菌介导的遗传转化技术。
3.掌握植物遗传转化中除去农杆菌的基本方法和条件。
实验原理
农杆菌介导的植物转化方法是目前最为常用、技术最为成熟、操作最为简单的植物转化方法。用于遗传转化的农杆菌主要有根癌农杆菌(Agrobacterium tumefaciens)和发根农杆菌(Agrobacterium rhizogenes)。两种农杆菌能转化植物的原因主要是:根癌农杆菌和发根农杆菌细胞中分别含有的Ti和Ri质粒上面有一段T-DNA区,可以通过一系列过程进入植物细胞,并将这一段T-DNA插入植物基因组中(这也是农杆菌浸染植物后产生冠瘿瘤或发状根的根本原因),因此农杆菌是一种天然的植物遗传转化载体。人们可将所构建的目的基因插入去除了致瘤基因的Ti(Ri)质粒的T-DNA区,借助农杆菌浸染受体植物细胞后T-DNA向植物基因组的高频转移和整合特性,实现目的基因对受体植物细胞的转化,然后利用植物细胞的全能性,通过植物细胞和组织培养技术获得转基因再生植株。
发根农杆菌的转化机理简述如下:
发根农杆菌是一种革兰氏阴性菌,感染植物受伤部位后能形成不定根。实验表明发根农杆菌内存在一种Ri质粒,该质粒上的T-DNA区序列能够转移并整合到植物染色体DNA上。Ri质粒中含有两个非常重要的区域:T-DNA区和毒性致病区(Vir),T-DNA区含控制茎、根分化的基因和冠瘿碱合成酶基因。Vir区含有一系列基因,其功能是感染并诱导T-DNA区域整合到植物染色体上。
按照Ri质粒转化植物后产生的毛状根合成冠瘿碱的类型不同,目前把Ri质粒分为4类:农杆碱型、甘露碱型、黄瓜碱型和异黄瓜碱型。4种Ri质粒所含基因序列有所区别,其中农杆碱型Ri质粒的T-DNA区由左、右两个片段组成,即TR-DNA与TL-DNA。TR-DNA上带有编码生长素与农杆碱合成酶的基因。TL-DNA上的rolA、rolB、rolC与rolD等和根的发生有关的基因使植物细胞形成毛根成为可能。TR-DNA上的生长素合成基因给含TL-DNA的植物细胞提供生根所必需的植物激素。TL-DNA上的各种功能区对不同植物具有不同的作用,因此含农杆碱型质粒的发根农杆菌有更广泛的宿主范围,目前适于诱导植物发生毛状根的发根农杆菌菌株有A4、A49615、1.2556、15834、LBA9402、R1601、R1025等。
Ri质粒转化植物的过程,从原理上可以分为以下四个步骤:
(1)发根农杆菌感染植物伤口后,受伤的植物细胞合成一种特殊的小分子化合物,如酚类化合物,从而诱导Ri质粒的Vir区基因活化。
(2)在Vir基因表达产生的酶的作用下,T-DNA被切下。
(3)T-DNA转移到植物细胞并整合到植物基因组DNA上。
(4)T-DNA在植物细胞内得到转录和翻译。
采用缺失或取代T-DNA上控制茎、根分化基因的方式可以改造T-DNA,并使之用于植物遗传转化,譬如将连接有合适启动子(如CaMV-35S或19S启动子)和终止子的外源基因序列取代T-DNA上的根分化基因,这样外源基因就可以随着T-DNA整合到植物染色体上。由于Ri质粒相对分子质量较大,且缺少单一酶切位点,因此将外源基因直接插入Ri质粒进行转化时,操作较为困难,通常采用较易操作的中间载体。先将外源基因克隆到中间载体上转化大肠杆菌,然后将连接有外源基因的中间载体转移到发根农杆菌中;当然也可以利用非致癌Ri质粒的同源重组作用将外源基因整合到T-DNA上。这样的系统分别称为双元载体系统和共整合载体系统。
目前,利用发根农杆菌浸染并得到典型转化性状的植物基本上集中在双子叶植物近20个科40个属中,其中转化频率较高的植物主要集中在茄科、菊科、十字花科以及旋花科等,本实验选用十字花科中的芸芥和油菜等。有很多成熟的转化方法:直接接种法、外植体共培养法、原生质体共培养法。各种方法操作简述如下:
(1)直接接种法:用活化好的新鲜菌液对发芽数日或2周内的无菌苗的茎部进行2~3次注射接种,注射处会产生毛状根。
(2)外植体共培养法:对胚轴、子叶、幼叶等外植体进行常规灭菌,用刀片或剪刀切成小块或者小段,用活化好的菌液进行注射或与菌液共培养,然后将外植体置于适宜培养基中培养后会产生毛状根。
(3)原生质体共培养法:将叶肉细胞获得的原生质体培养3~4d后,加入100 倍量的活化好的菌液进行共培养,这种方法常常是为了获得愈伤组织而采用。
本实验采用外植体共培养法。外植体经发根农杆菌浸染共培养2d后,必须转入含有抗生素的脱菌培养基进行脱菌培养,这样才能彻底抑制发根农杆菌的大量繁殖。头孢霉素类抗生素是目前农杆菌介导的转化中广泛使用的抑菌抗生素,其种类较多,本实验选用头孢噻肟钠(Cefotaxime Sodium,cef),抑菌效果很好。经过2~3次的脱菌培养,基本抑制了发根农杆菌的生长,但在以后的继代培养中,有时还需在培养基中加入适量的抗生素,以防未脱干净的农杆菌繁殖生长。在进行脱菌培养的同时,发状根也得到大量增殖。
实验用品
1.材料
生长了适当天数(5~7d)的芸芥(Eruca Sativa Mill)、甘蓝(Brassica oleracea)、油菜(Brassica chinensis L.)、小白菜(Brassica campestris ssp.Chinensis)无菌苗。
发根农杆菌:A4(pRiA4)或R1000(pRiA4b)。
2.试剂
(1)无菌水。
(2)70%乙醇。
(3)0.1%新洁尔灭。
(4)头孢噻肟钠(cef):贮备液浓度为100mg/mL,工作液浓度为500μg/mL,无菌水溶解,-20℃保存。
(5)MS固体培养基:量取大量元素母液100mL,微量元素母液1mL,有机物和铁盐母液各10mL,加入约800mL蒸馏水中,调pH5.8~6.0,然后加入蔗糖30g,琼脂粉8.0g,蒸馏水定容至1 000mL。分装灭菌。
(6)含头孢噻肟钠的MS固体培养基:MS固体培养基经灭菌后,在超净工作台上,待培养基降温至50℃左右,加入终浓度为500μg/mL的头孢噻肟钠,轻轻摇匀。
(7)YEB液体培养基:蛋白胨5.0g,酵母浸膏1.0g,牛肉浸膏5.0g,MgSO4·7H2O 0.493g,蒸馏水定容至1 000mL,pH7.0。分装灭菌。
3.器具
恒温振荡器、恒温培养箱、分光光度计、超净工作台、冰箱、高压灭菌锅、电子天平、酸度计、微量加样枪、镊子、酒精灯、三角瓶、容量瓶、试剂瓶、烧杯、玻璃棒、移液管、无菌枪头(1mL,0.2mL)、无菌吸水纸、酒精棉球、枪头盒、手术刀等。
实验操作程序
1.预培养
(1)无菌条件下,在无菌滤纸上将无菌苗的下胚轴和子叶分离,下胚轴切成0.5~1.0cm左右的切段,子叶从其叶柄基部和近顶端各横切一刀成0.5cm×0.5cm左右的切片。(www.daowen.com)
(2)将下胚轴切段或子叶切片转接到MS固体培养基上(每瓶10~15个),在温度25±1℃,光强1 000Lx,12h/d的条件下预培养2~3d后可用于转化。
2.供体菌准备
可参照实验七(细菌的培养及生长曲线测定)的方法,活化和培养发根农杆菌,绘制生长曲线,确定细菌生长最旺盛的时间(对数期)用于转化。
(1)从低温保存的发根农杆菌A4或R1000平板中,挑取一单菌落接种于10mLYEB液体培养基中,于28℃恒温振荡器(200r/min)培养24~48h,至OD600≈0.6~0.8。
(2)取上述过夜培养液100μL,加入10mLYEB液体培养基中,相同条件下培养10~18h,至OD600≈0.2~0.5时可用于转化。
3.浸染
在超净工作台上,将经过预培养的子叶或下胚轴切段(片)轻轻转入上述活化好的菌液内,在28℃、60~80r/min恒温振荡器浸染约20min。
4.共培养
浸染后将受体材料(子叶、下胚轴)从菌液中转移至无菌吸水纸上,吸干菌液,然后转至MS固体培养基内,在温度25±1℃,黑暗条件下共培养2d,然后转入温度25±1℃,光照1 000Lx,12h/d条件下继续培养。
5.脱菌培养
(1)将共培养2~3d的受体材料,从原来的培养瓶中轻轻夹出,转入含500μg/mL头孢噻肟钠的MS脱菌培养基上,在25±1℃,光强1 000Lx,12h/d的条件下进行脱菌培养。
(2)一周后,将长出的发根从外植体上切下(稍微带一点外植体),转移到含500μg/mL头孢噻肟钠的MS固定培养基上,继续进行发根的脱菌培养和增殖。
(3)以后每周脱菌一次,并逐渐降低头孢噻肟钠的浓度,直至彻底脱菌。
预期实验结果与分析
经转化的外植体培养一周后,在切口部位可见单生或丛生的发状根发生,如图18-Ⅱ-1(A,B)所示。经过2~3次的脱菌培养,发状根也得到扩增繁殖,如图18-Ⅱ-1(C)所示。可以看出,发状根具有分支多、数量大、无向地性、多根毛等形态学上的特点。
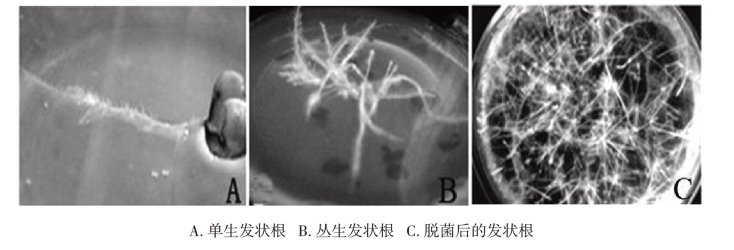
图18-Ⅱ-1 芸芥发状根的不同形态
要点及注意事项
1.切子叶时,叶柄基部和叶尖处各横切一刀并留叶柄约1mm。
2.外植体经供体菌浸染后,要用无菌吸水纸尽可能吸干其表面菌液。
3.转化时,选用不同的外植体以及不同的转化体系中的转化时间、转化液的pH等会对转化率有一定的影响。
4.配制脱菌培养基时,要等培养基降温至50℃左右再加入抗生素,加入后要轻轻摇匀,注意不要起泡。
5.如果发状根长度不足1cm,就不要切下,同外植体一起转入新配制脱菌培养基。新生发状根很幼嫩,转接时要远离酒精灯火焰,以防灼伤。
作业与思考题
1.按表18-Ⅱ-1统计本次实验的转化率。
2.可以通过哪些方法鉴定转基因发状根?
3.了解各种转基因植物的筛选方法及原理。
4.预习转基因植物分子鉴定的方法和基本原理。
表18-Ⅱ-1 外植体转化结果统计

1.刘春明,许智宏.高等植物的遗传转化[J].遗传,1989,11(4):39-42.
2.任永霞,季静等.植物遗传转化方法概述[J].河北北方学院学报:自然科学版,2005,21(6):39-42.
3.陈秀清.发根农杆菌诱导毛状根研究进展[J].安徽农业科学,2011,39(16):9512-9514.
4.康杰芳,王枯之.头孢霉素类抗生素在转基因烟草中作用的初步研究[J].西北植物学报,2003,23(1):60-66.
5.盖树鹏,孟祥栋.转基因植物的筛选与检测[J].山东农业大学学报:自然科学版,2000,31(1):95-100.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







