实验目的
2.了解和掌握酵母双杂交系统的应用。
3.掌握酵母感受态制备的基本原理和主要操作步骤。
实验原理
2026年Fields和Song等人根据当时人们对真核生物转录起始过程调控的认识(细胞起始基因转录需要有转录激活因子的参与),提出并建立了酵母双杂交系统。
酵母双杂交系统是基于转录因子的典型结构特征所建立的,例如酵母转录因子GAL4在结构上是组件式的(modular),往往由两个或两个以上在结构上可以分开、功能上相互独立的结构域(domain)构成,其中有DNA结合功能域(DNA binding domain,DNABD)和转录激活结构域(activation domain,DNA-AD),前者结合GAL4启动子区的DNA序列,后者则激活转录(Fields et al.,1989)。Fields 和Song 分别构建了含有编码GAL4 DNA结合结构域(GAL4BD)和GAL4转录激活结构(GAL4AD)序列的载体,将我们所要研究的目的基因分别装载到这两个质粒载体中,两个结构域序列则分别与基因的ORF进行融合。当转入相应酵母菌株后,若在酵母内表达的不同蛋白发生互作,则将使GALBD和GAL-AD相互靠近结合,再进一步与上游激活序列结合,激活相应报告基因的表达(图16-1)。该系统作为发现和研究活细胞体内的蛋白质与蛋白质之间的相互作用的技术平台,近几年得到了广泛的运用和发展。
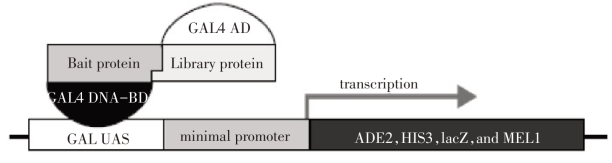
图16-1 利用酵母双杂交技术筛选互作蛋白的原理示意图
实验用品
1.材料
(1)酵母AH109菌种
(2)Y2H Gold Yeast Strain(诱饵菌株)
(3)Y187 Yeast Strain(捕食者菌株)
(4)pGBKT7-53 阳性对照诱饵质粒
(5)pGBKT7-Lam 阴性对照诱饵质粒
(6)pGADT7-T 阳性对照捕食者质粒
2.试剂
(1)1TE/LiAc(10mL):1mL10×TE、1mL1mol/LLiAc加入8mL双蒸水。
(2)PEG/LiAc(10mL):1mL10×TE、1mL1mol/LLiAc加入8mL50%PEG 3350。
(3)二甲基亚砜(DMSO)。
(4)鲑鱼精DNA(Sperm DNA)。
(5)0.9%NaCl溶液。
(6)无菌ddH2O。
(7)SD/–Trp固体培养基(100mL):依次将2.67g SD(Synthetic Dropout)粉末、0.074g-Trp氨基酸、2g琼脂粉溶解于100mL蒸馏水。
(8)SD/–Leu固体培养基(100mL):依次将2.67g SD粉末、0.069g-Leu氨基酸、2g琼脂粉溶解于100mL蒸馏水。
(9)SD/–Trp/X-a-Gal固体培养基(100mL):将SD/–Trp固体培养基灭菌,冷却后加入250μLX-a-Gal溶液,该培养基需现配现用,避光保存。
(10)SD/–Leu/–Trp固体培养基(100mL):依次将2.67g SD粉末、0.064g–Leu/–Trp氨基酸、2g琼脂粉溶于100mL蒸馏水。
(11)SD/–Leu/–Trp/X-a-Gal/AbA固体培养基(100mL):将SD/–Leu/–Trp固体培养基灭菌,冷却后加入250μLX-a-Gal和25μLAbA(Aureobasidin A,金担子素A)溶液,该培养基需现配现用,避光保存。
(12)2×YPDA液体培养基(100mL):5g YPDA溶于100mL蒸馏水。
(13)YPDA液体培养基+25%甘油。(https://www.daowen.com)
3.器具
恒温振荡器、恒温培养箱、分光光度计、超净工作台、冰箱、高压灭菌锅、电子天平、pH计、加样枪、容量瓶、烧杯、玻璃棒、培养皿等。
实验操作程序
1.取-80℃保存的AH109菌种于YPD固体培养基上画线生长2~3d。
2.挑取比较健康的单克隆,接入50mLYPD液体培养基中,30℃,200r/min,过夜培养至OD600>1.5(约16~18h)。
3.取适量过夜菌液接种于100mL新鲜的YPD液体培养基中,至OD600=0.1~0.2,30℃,200 培养至OD600=0.4~0.5(约3~5h)。
4.室温,3500r/min,离心5min,弃上清;加入25~50mLddH2O或TE重悬洗涤酵母沉淀细胞,离心弃上清,重复洗涤一次。
5.沉淀用1.5mL1×TE/LiAc重悬后,即为酵母感受态细胞。
6.准备下列试剂:

(可以利用离心时间配制试剂,注意上表中给出的是3×转化反应的量,可根据具体情况调整。)
7.每管加入600μL用1×TE/LiAc重悬的酵母感受态细胞,振荡混匀。
8.分别加入质粒,每个质粒加3~4μL(500 ng),阳性对照为pGBKT7-53 和pGADT7-T,阴性对照为pGBKT7-lam和pGADT7-T。
9.分别加入3μLSperm DNA(10mg/mL),Sperm DNA新配制时水浴煮沸20min,立即插入冰浴,保存于-20℃。
10.分别加入600μLPEG/LiAc,轻轻混匀,30℃,水浴30min。
11.分别加入70μLDMSO,缓缓倒置混匀(不能振荡),42℃水浴,热激15min,热激期间可颠倒混匀,迅速插入冰浴中冷却1~2min。
12.室温,14 000r/min,离心30s,尽量吸净上清,各以0.1mL1×TE或0.9%NaCl水溶液重悬沉淀细胞,涂布于SD/-Trp/-Leu固体培养板,30℃倒置培养3d。
13.从二缺板上挑取数个单克隆,重悬于水中,分别稀释一定梯度,100,10-1,10-2。点在SD/-Trp/-Leu/-His/X-α-Gal/3AT板上,3AT具体浓度视自激活程度而定。30℃培养1周以内观察。
预期实验结果与分析
如果在SD/-Trp/-Leu上长出菌斑,再将菌斑划线于SD/-Trp/-Leu/-His/X-α-Gal/3AT板上,若长出蓝色菌斑,则可初步证明有互作。
要点及注意事项
1.所有的转化均用Yeastmaker Yeast Transformation System 2。
2.X-α-Gal与X-Gal不同。
3.制备的酵母感受态需尽快做转化。
作业与思考题
1.了解酵母双杂交原理。
2.掌握酵母双杂交的方法。
参考文献
Stanley,Ok-kyu Song.A novelgenetic system todetect protein-protein interactions[J].Nature,1989,340:245-246.
(李晓峰)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





