实验目的
1.了解噬菌体感染的原理及噬菌体效价的意义和用途。
2.掌握噬菌体感染及其效价测定的基本技术。
实验原理
噬菌体(bacteriophage,phage)是感染细菌、真菌、放线菌或螺旋体等微生物的病毒总称,因部分能引起宿主菌的裂解,故称为噬菌体。它们由一个保护性的蛋白质外壳包围着单链或双链DNA或RNA基因组组成。噬菌体具有病毒的一些特性:个体小、可通过除菌滤器、没有细胞结构、非常专一的寄生性等。噬菌体分布极广,凡是有细菌的场所,就可能有相应噬菌体的存在。噬菌体具有严格的宿主特异性,只寄居在易感宿主菌体内,故可利用噬菌体进行细菌的流行病学鉴定与分型,以追查传染源。由于噬菌体结构简单、基因数量少,所以是分子生物学与基因工程的良好实验体系。了解噬菌体的特性,掌握快速检测、分离和进行效价测定的方法,对于生产和科研中防止噬菌体的污染具有重要意义。
虽然噬菌体基因组含有许多个基因,但所有已知的噬菌体都是在细菌细胞中,利用细菌的核糖体、蛋白质合成时所需的各种因子、各种氨基酸及能量产生系统来实现自身的生长和增殖,因此,一旦离开宿主细菌,噬菌体既不能生长,也不能复制。当把细菌涂布在培养基面上长成一层菌苔时,每个噬菌体感染一个细菌,经过裂解周期,宿主细胞破裂后,释放出大量子代噬菌体,然后它们再扩散和侵染周围细胞,结果在菌苔上形成一个圆形清亮的噬菌斑(plaque)。噬菌斑的形成可用于分离、纯化噬菌体和进行噬菌体计数。一个噬菌斑来自最初涂布平板时的一个噬菌体,即从单个噬菌斑上获得的噬菌体就是一个噬菌体克隆,都有相同的基因组。
有一类噬菌体感染细菌后,并不一定使细胞死亡,故这类噬菌体称为温和噬菌体。λ噬菌体就是一种温和噬菌体,感染大肠杆菌后能经历溶源性或裂解性两种生长途径。当λ噬菌体感染宿主菌时,噬菌体附着在细胞表面,将它的DNA注入细胞,外壳蛋白则留在外面。在进行溶源性生长时,λ噬菌体将其自身的DNA整合进细菌的染色体DNA中,随细菌染色体DNA复制并传递给后代,这个稳定潜伏在细菌染色体DNA中的整套λDNA称为原噬菌体(prophage),含有原噬菌体的细菌称为溶源性细菌(lysogenic baclerium)。溶源性细菌不会产生子噬菌体颗粒,也不会裂解。原噬菌体经历一段较长的潜伏期后,当受到物理或化学因素的刺激时溶源周期终止而引发裂解。进入裂解性生长途径时,由于受到外界因素的刺激,宿主菌染色体DNA受到损伤,λDNA便从染色体DNA中分离出来,在宿主细胞内经过复制和重新包装后形成新的噬菌体颗粒,宿主细胞就会因原噬菌体的增殖而裂解死亡,释放出大量子代噬菌体颗粒。
噬菌体效价(Plague forming unit,PFU),是指单位体积(mL)噬菌体裂解液感染宿主菌后所形成的噬菌斑数目。这是衡量噬菌体活力的重要指标。噬菌体效价测定的方法一般采用双层琼脂平板法。把噬菌体原液做适当稀释并与一定量的宿主菌混合感染,然后加入融化的软琼脂培养基,混合后平铺于LB固体平板培养基上并于37℃条件下过夜培养。根据每一个平板上形成的噬菌斑数目、稀释液的体积和稀释倍数可得出被测噬菌体原液的效价。双层琼脂平板法所形成的噬菌斑(图11-1),在其形态、大小上比较一致,且清晰度较高,计数比较准确,因而被广泛应用。
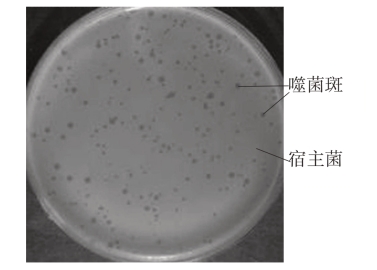
图11-1 双层琼脂平板上的噬菌斑
实验用品
1.材料
λ噬菌体(λphage),大肠杆菌(E.coli)ER-1647。
2.试剂与培养基
(1)无菌蒸馏水。
(2)三氯甲烷(氯仿)。
(3)5mol/LNaOH溶液。
(4)1mol/LHCl溶液。
(5)λ噬菌体悬浮液(SM):称取5.8g NaCl 和2g MgSO4·7H2O溶于800mL蒸馏水中,再加入50mL1mol/LTris-HCl(pH7.5,见附录八)和5mL2%明胶溶液,蒸馏水定容至1 000mL,灭菌。
(6)1mol/L硫酸镁贮备液:称取24.67g MgSO4·7H2O溶于100mL蒸馏水中,灭菌。
(7)20%麦芽糖贮备液:称取20g麦芽糖溶于100mL蒸馏水,用无菌0.22μm滤膜过滤灭菌,4℃保存。
(8)12mg/mL四环素贮备液(Tet.):称取0.12g四环素溶于10mL无菌蒸馏水,用无菌0.22μm滤膜过滤灭菌,分装于无菌离心管,-20℃保存。
(9)LB液体培养基:称取10g蛋白胨、5g酵母浸膏、10g NaCl溶于1 000mL蒸馏水,pH7.2,灭菌。
(10)LB软琼脂培养基:于LB液体培养基中加入0.7%琼脂粉,灭菌。
(11)LB固体平板培养基:于LB液体培养基中加入1.5%琼脂粉,灭菌。
3.器具
超净工作台、恒温振荡器、恒温培养箱、恒温水浴锅、离心机、电子天平、722分光光度计、加样枪、无菌培养皿(φ90mm)、无菌带盖玻璃试管(φ15mm×100mm)、无菌1.5mL离心管、无菌枪头(0.2mL,1mL)、三角瓶(50mL,100mL)、离心管盒、试管架、镊子、酒精灯等。
实验操作程序
1.受体菌活化
挑取一环受体菌(E.coli ER1647),接种于含四环素(终浓度12μg/mL)的10mLLB液体培养基中,置于30℃恒温振荡器内在250r/min条件下过夜培养,使受体菌活化。
2.受体菌培养
取10mLLB 培养液一瓶,加入20%麦芽糖和1mol/L硫酸镁各100μL,然后加入过夜培养的受体菌液100μL并混合。于37℃恒温振荡器(250r/min)内培养5~6h,当测OD600为1.0~1.5时,于4℃冰箱保存备用(1周内有效)。
在过夜培养中,于30℃培养将使细胞不易长至饱和状态,培养基中细胞碎片的量也保持在最低。如果把噬菌体加入饱和培养物中,会吸附于细胞碎片上而导致无效感染。
麦芽糖可诱导细胞膜上麦芽糖外膜蛋白受体(特异的噬菌体受体)的产生,使大肠杆菌更具有敏感性,利于噬菌体的结合和吸附,该受体的合成受麦芽糖的诱导却被葡萄糖所抑制。Mg2+的存在能促进噬菌体和受体菌的吸附作用。
3.预热平衡
将配制好的LB软琼脂培养基在沸水浴中融化,待降温后添加终浓度为10mmol/L的硫酸镁(50mL软琼脂中加500μL),然后在48℃恒温水浴中平衡1~2h备用。同时将LB固体平板培养基置于37℃恒温培养箱内预热平衡1~2h备用。
4.稀释裂解液(https://www.daowen.com)
在超净工作台上,取6支干净无菌的1.5mL离心管并编号,每管各加入0.9mLλ噬菌体悬浮液(SM)或LB培养液。另取1支λ噬菌体原液,吸取0.1mL加入1号管中混合均匀,再从1号管(10-1)中吸取0.1mL加入2号管中混匀,依此类推,按10倍梯度稀释至10-6。
5.感染吸附
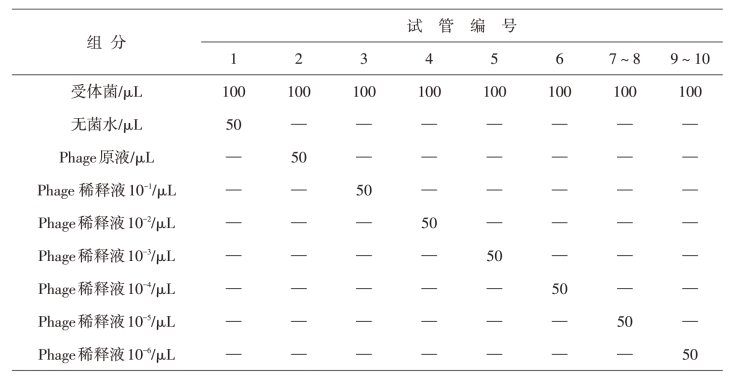
取10支无菌带盖试管编号,按下表(表11-1)所示分别加入相应组分,混合后置于37℃恒温振荡器内,在150r/min条件下振荡培养30min。让噬菌体颗粒充分吸附并侵入受体菌细胞。
表11-1 λ噬菌体感染取样表
6.双层培养
于上述每支试管中加入3~4mL预平衡的软琼脂培养基,迅速混匀后,立即倒入预平衡的、具有相应编号的LB固体平板中央表面,边倒入边轻轻旋转平板,使软琼脂均匀地分布于平板表面。室温下水平静置10min使之凝固,最后倒置于37℃恒温培养箱过夜培养。
如果在室温条件下培养,λ噬菌体DNA的注入及其在随后裂解周期中的一些活动将难以有效地进行,因而不能形成噬菌斑,除非室温超过28℃。
7.观察统计
次日观察,可以看到部分长满菌苔的平板上出现透亮的噬菌斑。观察并统计噬菌斑的数目,记录于下表(表11-2)。
表11-2 λ噬菌体效价测定记录表

8.收集裂解液
选择1~2个噬菌斑清晰、数目多的培养皿,加入10mL噬菌体悬浮液(SM),室温下50r/min振摇2h。然后收集裂解液于无菌离心管中,加入1~2滴氯仿后振荡混合,于4℃条件下保存。使用前离心,取用上清液。
对大多数噬菌体而言,在含有少量氯仿(约0.3%,V/V)的SM液中于4℃条件下保存是十分稳定的。
预期实验结果与分析
选取30~300个噬菌斑数的平板,按下式计算该噬菌体每mL原液的效价:
噬菌体效价(PFUs/mL)=噬菌斑平均数×稀释倍数×取样量(折算成1mL)
未感染噬菌体的平板(1号)应形成一片光滑的菌苔。噬菌体原液的稀释倍数越小,平板中噬菌斑越密集甚至连成片,无法计数;可选择稀释倍数高的10-5或10-6平板统计噬菌斑的数目,取平均值计算效价。
要点及注意事项
1.在稀释和感染操作过程中,加样量要准确,并注意更换枪头。
2.软琼脂培养基每次加入试管后应置于水浴锅保温,防止凝固。
3.平铺上层软琼脂培养基的过程中,动作要快并防止污染。
4.SM液中加入明胶的目的是有助于稳定噬菌体颗粒。
作业与思考题
1.根据统计结果计算λ噬菌体的效价(表11-2)。
2.要提高噬菌体效价测定的准确性,应注意哪些操作?
3.在受体菌活化过程中,加入麦芽糖和硫酸镁有何作用?
4.噬菌斑的大小是由什么因素决定的?
参考文献
1.乔守怡.遗传学分析实验教程[M].北京:高等教育出版社,2008.
2.王金发,戚康标,何炎明.遗传学实验教程[M].北京:高等教育出版社,2008.
3.沈萍,范秀容,李广武.微生物学实验[M].3版.北京:高等教育出版社,1999.
4.Sambrook J, Russell D.W.分子克隆实验指南[M].3版.黄培堂等,译.北京:科学出版社,2002.
5.赵寿元,乔守怡,现代遗传学[M].2版.北京:高等教育出版社,2008.
(牛炳韬)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





