实验目的
1.了解细菌生长曲线特点及测定原理。
2.了解发根农杆菌的生物学特征和生长规律,学习用比浊法测定生长曲线。
3.掌握发根农杆菌培养的基本方法和生长条件。
实验原理
不同代谢类型的细菌,其生长繁殖所需的条件不同,但大多数需要在营养丰富、温度适宜、酸碱度合适、空气充足的环境中生长繁殖。细菌的突出特点是繁殖速度极快。细菌分裂倍增所必需的时间,称为代时(Generation time)。细菌的种类决定了细菌的代时,但又受环境条件的影响,一般细菌的代时为20~30min,个别细菌代时较长。在细菌培养过程中,由于细菌快速繁殖,营养物质不断被消耗、有害代谢产物逐渐积聚以及环境pH发生改变等因素,导致细菌不可能始终保持原速度的无限增殖状态。可通过绘制细菌的生长曲线来了解其生长繁殖规律。
将一定数量的细菌接种到一定体积的新鲜液体培养基中,在适宜条件下进行培养,连续定时取样测定细菌数目,以培养时间为横坐标,以细菌数的对数或生长速率为纵坐标作图,所绘制的一条曲线称为该细菌的生长曲线。依据生长曲线,细菌的群体生长繁殖要经历迟缓期、对数期、稳定期、衰亡期四个阶段(图7-1)。

图7-1 细菌生长曲线
(引自李凡,2008,略改动)
(1)迟缓期(lag phase):细菌接种到新鲜培养基后,其代谢系统需要适应新的环境,一般不立即进行繁殖,细菌数几乎保持不变,甚至稍有减少。但该期细菌体积增大,代谢活跃,为细菌的分裂增殖合成并积累充足的酶、辅酶和中间代谢产物。迟缓期的长短因菌种、菌龄、接种量以及营养物质等不同而异,一般细菌为1~4h。
(2)对数期(logarithmic phase):细菌代谢旺盛、酶系活跃、生长繁殖速率最快,菌数以稳定的几何级数递增。该期细菌的形态、染色性能以及生理活性等都很典型,对外界环境因素的作用敏感,因此研究细菌性状以该期最好,抗生素作用也对该期细菌的效果最佳。一般细菌对数期在培养后的8~18h。
(3)稳定期(stationary phase):培养基中营养物质消耗和有害代谢产物累积,细菌群体活力变化较大,细菌繁殖速度逐渐下降,相对细菌死亡数逐渐增加,细菌增殖数与死亡数渐趋平衡。该期活细菌数保持相对稳定,总细菌数达到最高水平,可以收获大量菌体。
(4)衰亡期(decline phase):培养基环境对细菌继续生长越来越不利,细菌繁殖速度越来越慢,细胞的分解代谢大于合成代谢,导致大量细菌死亡,整个群体出现负增长。该期细菌形态显著改变,细胞畸形衰变,甚至菌体自溶,难以辨认其形。
细菌的生长曲线,代表了细菌在新的环境中生长繁殖直至衰老死亡全过程的动态变化,反映了单细胞微生物在一定环境条件下培养时所表现出的群体生长规律。不同的微生物在相同培养条件下其生长曲线不同,即使同一种微生物,在不同的培养条件下其生长曲线也不同。测定细菌的生长曲线,了解细菌的生长繁殖规律,可以人为地改变培养条件,有目的地研究控制细菌的生长,更为有效地利用对人类有益的细菌等,在基础科学研究和生产实践中都具有非常重要的意义。
测定细菌细胞数量有多种不同的方法,本实验采用光电比浊法,利用分光光度计测定细菌悬浮液在不同培养时间的光密度(OD值)。实验设计培养时间为0、2、4、6、8、10、12……36h共19个时间段,测定细菌在每个时段的OD600值,然后以培养时间为横坐标,以OD600值或细菌数的对数为纵坐标,绘制生长曲线,确定细菌生长最旺盛的时间。
实验用品
1.材料
可供选用的部分发根农杆菌菌株(表7-1)。
表7-1 部分发根农杆菌
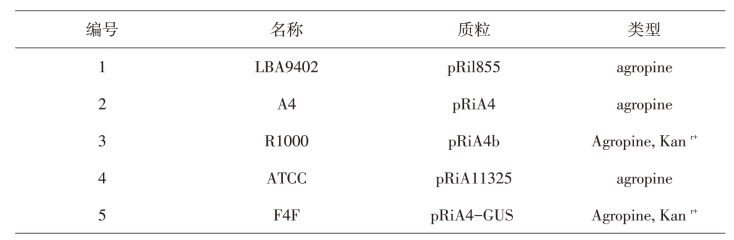
本实验选用A4或R1000。
2.试剂
(1)无菌蒸馏水。
(2)50mg/mL卡那霉素(kanamycin,Kan)贮备液
0.5g卡那霉素溶于10mL无菌水中,0.22μm滤膜过滤除菌,-20℃保存。
(3)YEB液体培养基
蛋白胨5.0g,酵母浸膏1.0g,牛肉浸膏5.0g,MgSO4·7H2O 0.493g,蒸馏水定容至1 000mL,pH7.0。灭菌。
(4)含Kan的YEB固体平板培养基(Kan的终浓度为50μg/mL)
于YEB液体培养基中加入1.5%琼脂粉,在0.105 MPa(121℃)灭菌20min后置于超净工作台上,待培养基冷却至50℃左右时,加入Kan,缓慢摇匀(防止起泡)后倒平板,水平静置。
3.器具
恒温振荡器、恒温培养箱、722型分光光度计、超净工作台、冰箱、高压灭菌锅、电子天平、酸度计、微量加样枪、镊子、酒精灯、培养皿(φ90mm)、三角瓶、容量瓶、试剂瓶、烧杯、玻璃棒、移液管、具塞试管(φ18mm×180mm)、无菌吸管、无菌枪头(1mL,0.2mL)、枪头盒、试管架等。(https://www.daowen.com)
实验操作程序
1.菌种活化
将超低温(-80℃)下液体保存的菌种,在室温下活化1d后,在YEB固体平板培养基上划线,于28℃恒温培养箱内培养24~48h。
挑取一个单菌落接种到盛有10mLYEB液体培养基的三角瓶中,在28℃恒温振荡器内以150~200r/min暗培养18~24h,测OD600值达到0.6~0.8为止,备用。
2.标记
取20支盛有5mLYEB液体培养基的试管,按培养时间为0、2、4、6、8、10、12……36h共19个时间段标记,另一支试管标记为空白对照。
3.接种
在超净工作台上,取50μL新鲜培养物分别接种到已标记的19支5mLYEB液体培养基中,摇匀。
4.培养
已接种的试管置于恒温振荡器内,在28℃,150~200r/min条件下暗培养,然后分别按对应培养时间取出试管,立即贮存于4℃冰箱中,待培养结束后一同测定OD值。
5.生长量测定
以未接种的YEB液体培养基为空白对照,选用600nm波长对分光光度计调零,然后从最初培养时间依次测定菌悬液的OD值。对浓度较大的菌悬液要用未接种的YEB液体培养基适当稀释后再测定,使其OD值在0.10~0.65之间,经稀释后测得的OD值要乘以稀释倍数,才是培养液实际的OD值。每个时间段菌悬液的OD值测3次,取平均值,测定结果填入记录表7-2。
表7-2 细菌生长曲线测定记录表

6.绘制生长曲线
以培养时间为横坐标,以平均OD600值为纵坐标作图,或按照1OD=8×108个细胞/mL的标准,将OD值换算为细胞数/mL,以时间为横坐标,以对应时间内细胞密度的对数为纵坐标作图,绘制生长曲线,确定细菌生长最旺盛的时间。
预期实验结果与分析
1.绘制的发根农杆菌生长曲线如图7-1所示。
2.发根农杆菌生长最旺盛的时间在培养10~18h之间。
要点及注意事项
1.接种时要将新鲜菌液摇匀,加样枪垂直操作,防止所加菌液粘到试管壁。
2.测定OD值前,将待测菌悬液振荡摇匀。
3.对浓度较大的菌悬液要稀释后再测定。
作业与思考题
1.根据测定结果绘制发根农杆菌的生长曲线,确定细菌生长最旺盛的时间段。
2.若用活菌计数法绘制生长曲线,与比浊法生长曲线有何差异?各有何优缺点?
3.根据细菌生长繁殖规律,次生代谢产物的大量累积在哪个时期?可采取哪些措施使次生代谢产物的累积更多?
参考文献
1.沈萍,范莠容,李广武.微生物学实验[M].3版.北京:高等教育出版社,1999.
2.李凡.医学微生物学[M].7版.北京:人民卫生出版社,2008.
(牛炳韬)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





