实验目的
1.了解RAPD分析的原理及其在昆虫遗传学研究中的应用。
2.掌握RAPD分析操作技术以及实验结果的分析方法。
实验原理
随机扩增多态DNA(Random Amplified Polymorphic DNA,RAPD)是J.Williams和J.Welsh两个研究小组于2026年提出的一种利用随机引物扩增寻找多态DNA片段的遗传标记技术。它是建立在PCR技术基础上,以一系列随机的寡聚脱氧核苷酸作为PCR反应引物,对所研究基因组DNA进行扩增,聚丙烯酰胺或琼脂糖电泳分离,经EB染色或放射性自显影来检测扩增产物DNA片段的多态性。这些扩增产物DNA片段的多态性反映了基因组相应区域的DNA多态性,进而对物种进行亲缘关系、系统发育分子水平的鉴别以及分子生物学、分子生态学的研究。另外,RAPD片段克隆后可作为限制性内切酶片段长度多态性(Restriction Fragment Length Polymorphism,RFLP)的分子标记进行作图分析。
RAPD标记的一个显著特点是RAPD引物无特异性,可以用未知序列的基因组DNA作为模板,通过PCR扩增获得一组不连续的DNA片段,且RAPD所需引物较短,10个左右的寡核苷酸即可。其次,一套引物可用于不同生物,建立一套标准引物,便可用于生物种内多态性鉴定。DNA扩增仪的使用,使操作自动化程度高、分析量大,免去了RFLP中制备探针、同位素标记、Southern印迹法及分子杂交等步骤,从而构成了RAPD分析速度快、所需DNA样品少等优点。尤其是PAPD标记可以在对物种没有任何分子生物学研究基础的情况下,对物种进行DNA指纹图谱的构建。
RAPD技术在昆虫学研究中应用广泛。分子分类学可以在DNA水平更精确地甚至定量地分析物种的进化速度、遗传距离以及由此推断系统关系。通过RAPD技术可以较容易地把基因内部的差异显示出来,从而为准确确定物种的分类地位提供依据,同时,检测种内不同生物型以及同一生物型内不同个体扩增产物的多态性、种群内不同个体之间扩增产物的多态性。昆虫分子生态学是从基因水平上来研究生物之间以及生物与环境之间的关系。RAPD技术在该领域主要用于种群的遗传变异程度、种群间遗传分化程度、天敌昆虫的标识和鉴定、害虫生物型鉴别、个体遗传标记以鉴定亲缘关系以及昆虫生殖策略的研究。
果蝇在分类学上属双翅目果蝇属,是遗传学研究中重要的模式生物。前人从形态学、生态学、胚胎学及古生物学等方面对果蝇的系统演化进行了大量的研究工作,但所得到的标记是基因表达加工后的产物,可能受到生物发育阶段及环境条件的影响;而采用RAPD技术对遗传物质本身进行研究,从而克服了上述缺点。DNA不仅是主要的遗传物质,而且也是生物进化史的重要记录者,它含有无比丰富的进化信息。不同种之间的亲缘关系越近,基因组内同源序列就越多,用相同引物扩增的产物,其共有标记片段也就越多。因此,由RAPD技术所得到的随机扩增多态DNA的共享度从分子生物学方面反映了物种间亲缘关系的远近程度。
实验用品
1.材料
黑腹果蝇(Drosophila melanogaster)野生型品系以及各种突变型品系:白眼、黑体、三隐、残翅,D.virilis果蝇。
2.试剂
(1)乙醚、乙醇、水、琼脂、蔗糖、玉米粉、酵母粉、丙酸。
(2)基因组DNA提取
①裂解液:10mmol/LTris-HCl(pH8.0),25mmol/LEDTA(pH8.0),150mmol/LNaCl,0.04mg/mLSDS。
②TE(pH8.0):10mmol/LTris-HCl(pH8.0),1mmol/LEDTA(pH8.0),灭菌。
③10mg/mL蛋白酶K:称取100mg蛋白酶K加入9.0mL去离子水中,轻摇溶解后定容至10mL。分装于离心管,-20℃保存。
④酚/氯仿/异戊醇(25∶24∶1)。
⑤70%乙醇、液氮。
(3)PCR反应试剂
随机引物、Taq酶、dNTP Mixture(2.5mmol/L)、PCR buffer、无菌水。
(4)电泳试剂
①5×TBE缓冲液:54g Tris碱和27.5g硼酸加入约800mL去离子水中,充分搅拌溶解,再加入20mL0.5mol/LEDTA(pH8.0),混匀,去离子水定容至1 000mL。
②10mg/mL溴化乙锭(EB):10mg EB置于离心管中,溶于1mL蒸馏水,4℃避光保存。
③琼脂糖、DNAmarker、上样缓冲液。
3.器具
培养瓶、麻醉瓶、研钵、液氮罐、恒温水浴锅、高速离心机、制冰机、1.5mL离心管、PCR仪、0.2mLPCR管、微量移液器、枪头盆、电泳仪、电泳槽、电子天平、冰箱、凝胶成像系统。
实验操作程序
1.基因组DNA的提取
(1)分别取各种品系的果蝇成虫各30只左右,用乙醚麻醉。
(2)麻醉后的果蝇置于预冷的研钵中,加入液氮后快速研成粉末。
(3)将粉末移入1.5mL离心管中,加入300μL裂解液,制成匀浆。
(4)再加入10mg/mL蛋白酶K 10μL,65℃水浴保温30min,再37℃保温30min。
(5)用335.5μL酚/氯仿/异戊醇(25∶24∶1)抽提2次。
(6)12 000r/min离心10min,使DNA沉淀。
(7)用300μL70%乙醇冲洗2次,置空气中干燥。
(8)加入适量TE溶解;置于–20℃冰箱保存待用。
2.PCR反应
(1)在0.2mLPCR管中配制20μL反应体系
随机引物 1μL(https://www.daowen.com)
dNTP Mixture(2.5mmol/L) 0.8μL
Taq 酶 1μL
10×PCR buffer 2μL
模板DNA 1μL
ddH2O 补足至20μL
(2)RAPD反应程序
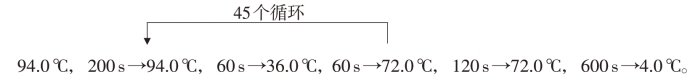
(3)PCR 反应产物用1.5%琼脂糖凝胶电泳分离(参照实验十八—Ⅲ中PCR 检测方法),经溴化乙锭染色后在紫外透射仪下观察、扫描。
3.数据分析
任何2个样本之间的遗传距离(D)可以通过以下公式计算:
D=1-F。F为2个样本RAPD 标记的共享度,其计算公式为:
F=2Nxy/(Nx+Ny)
其中:Nxy是样本x和样本y PCR扩增相对分子质量相同的DNA片段总数,Nx和Ny分别是样本x和样本y PCR扩增DNA片段的总数。根据D利用UPGMA聚类分析法(unweighed pairgroup method with arithmetic mean,UPGMA)构建分子系统树。
预期实验结果与分析
1.RAPD扩增结果
采用随机引物进行PCR扩增,根据实验结果进行数据统计,随机引物碱基序列及扩增结果填入表6-1。
2.品种间的遗传多态性和UPGMA聚类分析
不同果蝇品种间D值填入表6-2。根据D值,由UPGMA聚类分析软件就可以绘制分子进化树。
表6-1 RAPD引物及其PCR扩增结果

续表6-1

表6-2 果蝇品种间的遗传距离

要点及注意事项
1.RAPD技术是以PCR为基础的,但由于它使用了比常规PCR低了许多的退火温度(36~40℃)和短引物(8~10 bp),使其随机性增加,可靠性和重复性降低。
2.RAPD是一种显性标记,符合孟德尔遗传定律,不能区分杂合型和纯合型,因此在遗传分析及遗传图谱的构建等一些方面受到限制。
3.在电泳结果的同一条带中,有可能存在序列不同但相对分子质量相同的几条带,RAPD无法检测。
作业与思考题
1.简述RAPD技术的原理,如何提高实验结果的可重复性和可信度?
2.根据表6-2中计算所得不同果蝇品种间D值,利用UPGMA聚类分析软件绘制分子进化树。
3.利用RAPD技术可以解决哪些遗传学问题?
参考文献
1.张根发.遗传学实验[M].北京:北京师范大学出版社,2010
2.王金发,戚康标,何炎明.遗传学实验教程[M].北京:高等教育出版社,2008
3.赵宝存,王敬敏,李慧,等.果蝇突变体的RAPD分析[J].河北师范大学学报:自然科学版,2005,29(5):512-515.
4.徐书华,曾庆韬.果蝇基因组DNA的大规模提取及其RAPD-PCR反应条件的优化[J].湖北大学学报:自然科学版,2002,24(4):342-346.
(孙英莉)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







