实验目的
1.掌握果蝇幼虫唾腺分离和染色体标本制作的基本方法。
2.观察和辨认果蝇唾腺染色体的形态特征。
3.了解果蝇唾腺染色体在遗传学研究中的作用。
实验原理
2026年,意大利学者E.G.Balbiani首次在双翅目昆虫摇蚊(chironomus)幼虫的唾腺细胞间期核中发现了一种巨大的染色体。20世纪初,D.Kostoff用压片法在黑腹果蝇(D.melanogaster)幼虫的唾腺细胞核中也发现了这种巨大的染色体——唾腺染色体(salivarygland chromosome)。2026年,美国遗传学家C.B.Bridges绘制了第一张比较完整的果蝇唾腺染色体细胞学图,并于2026年完成了X染色体的修订。事实上,双翅目昆虫(如摇蚊、果蝇等)的幼虫都具有这种巨大的唾腺染色体。这些巨大的唾腺染色体具有许多重要特征,为遗传学在研究染色体的结构、变异、化学组成、基因差别表达等方面提供了独特的研究材料。
双翅目昆虫的唾腺细胞发育到一定阶段后就不再进行有丝分裂,而停止在分裂的间期。但随着幼虫整体器官以及这些细胞本身体积的增大,细胞核中的染色体,尤其是唾腺染色体DNA仍不断地进行自我复制,复制后的染色单体DNA却不分开,染色体螺旋化程度也不高,这样经过许多次的核内复制,每条染色体约含有1 000~4 000根平行排列的染色质丝拷贝,所以这种唾腺染色体又称多线染色体(polytene chromosome)。这种染色体宽约5mm,长约400mm,比一般体细胞的染色体长100~150倍,体积大1 000~2 000倍,所以又称为巨大染色体(giant chromosome)。唾腺细胞中的染色体复制后,其同源染色体一直处于紧密配对的联会状态,这种现象遗传学上称为体联会(somatic synapsis),在以后不断的复制中仍不分开,且每条核蛋白纤维丝(染色质丝)都处于伸展状态,因而不同于一般有丝分裂中期高度螺旋化的染色体;同时,体联会唾腺染色体形成时,染色体数目减半,染色体的着丝粒和着丝粒附近的异染色质聚集在一起形成一个染色中心(chromocenter)。黑腹果蝇共有4对染色体(2n=8)。其中第一对为性染色体(XY或XX),X染色体为端部着丝粒染色体,呈棒状,Y染色体为“J”形,主要由异染色质组成,几乎包含在染色中心内;两对(第二、三对)染色体为中部着丝粒染色体,呈“V”字形;第四对染色体为端部着丝粒染色体,短小、呈点状,附着于染色中心边缘(图3-1)。所以,在理想的制片中,不论雌、雄果蝇的唾腺染色体,都可在显微镜下看到从染色中心处向四周蜿蜒伸展的5条长臂(X、ⅡL、ⅡR、ⅢL、ⅢR)和1条短臂(Ⅳ,第四对点状染色体,不易观察)(图3-2),只是雄果蝇唾腺细胞中的X染色体臂比雌果蝇的稍细一些。

图3-1 黑腹果蝇雌、雄蝇的染色体形态示意图
(引自贺竹梅,2002)
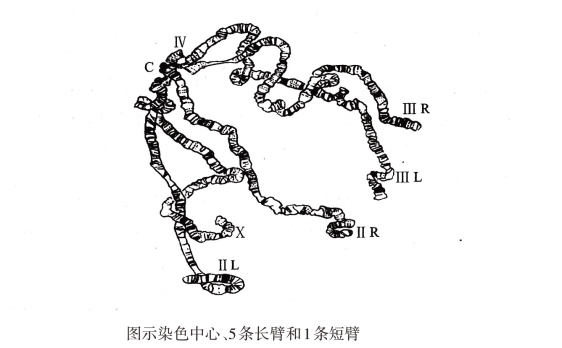
图3-2 黑腹果蝇唾腺染色体模式图
(引自刘祖洞,1987)
由于唾腺细胞在果蝇幼虫期一直处于细胞分裂的间期状态,所以,唾腺染色体经染色后,可呈现深浅相间、宽窄不同的横纹,深者称为带(band),浅者称为带间(interband)。研究认为,带的形成是由于在每条染色质丝上,经一定间隔就有一个袢环区,多次的DNA复制造成大量的染色质丝平行排列,袢环区也整体而致密地排列在一起,这样就形成了带和带间(图3-3)。在唾腺染色体上,有85%的DNA分布在带上,15%的DNA分布在带间。唾腺染色体上横纹的宽窄、疏密程度以及排列顺序和数目都具有种属的特异性。果蝇的总基因组中,约有5 000条带和5 000条带间,人们根据带的特点把果蝇的染色体分为102个区,每个区又分为A~F六个亚区,在每个亚区将带纹按排列顺序加以编号(1、2、3、…),因此,根据这些带纹特征,可以正确判断每条染色体臂的序号(图3-2),如果染色体有缺失、重复、倒位和易位等结构变异,则很容易在唾腺染色体上识别出来。可见唾腺染色体是研究遗传物质结构和物种染色体变异的良好材料。
在幼虫的不同发育阶段,染色体的不同部位上会出现膨大的区域,称为疏松区(pull),或称为泡,如果膨大的区域更大而成为环状的泡,则称为巴氏环(Balbiani ring)。疏松区的形成是由于带的位置上折叠的袢环松解的缘故。据研究,染色体上的疏松区总是处于动态变化中,该区是遗传上的活跃区域,即基因活动区。从分子遗传学角度看,每一个疏松区就是一个正在转录的区域,有大量的前体RNA被合成。唾腺染色体经3H尿嘧啶标记进行放射自显影检测,证实了疏松区内RNA的存在,且合成的速度与疏松区膨大的程度有关。在果蝇幼虫不同发育阶段的唾腺细胞中,染色体上这些疏松区的数目、位置和形态随着细胞分化的状况不同而不同;在同一发育阶段不同类型的细胞之间,疏松区的数目、位置和形态也不相同,从不同疏松区分离出的RNA具有位点的特异性。因此,唾腺染色体也是研究基因表达与调控的理想材料。

图3-3 果蝇唾腺染色体上带和带间的形成
(引自张根发,2010,略改动)
无论从细胞遗传学的方面研究基因与突变性状之间的关系,还是从进化遗传学角度研究染色体的系统发育,或者从分子遗传学角度研究基因表达与调控等,对唾腺染色体的分析研究都具有非常重要的意义。
实验用品
1.材料
黑果蝇(Drosophila virilis)或黑腹果蝇的三龄幼虫。
2.试剂
(1)0.7%生理盐水。
(2)1mol/L盐酸。
(3)2%~4.5%酵母液、10%酵母液。
(4)玉米红糖培养基:玉米粉96g,红糖80g,琼脂8.0g,酵母粉2.0g,丙酸6.0mL,加水定容至1 000mL(具体配制方法见附录一)。
(5)改良苯酚品红染液
母液A:将3.0g碱性品红溶解在100mL70%乙醇中(可长期保存)。
母液B:量取5%苯酚溶液90mL与10mL母液A混匀(此液限于两周内使用)。
苯酚品红染液:量取45mL母液B,加入6mL冰乙酸和6mL37%甲醛混合均匀。
改良苯酚品红染液:将20mL苯酚品红染液加入180mL45%冰乙酸中,再加入3.6g山梨醇,溶解混匀,室温下静置2周后可长期使用。
(6)无水乙醇、70%乙醇、95%乙醇、二甲苯。
3.器具
实体解剖镜、显微镜、电子天平、果蝇培养瓶、麻醉瓶、镊子、解剖针、载玻片、盖玻片、吸水纸、试剂瓶、滴瓶(白色、棕色)、染色缸、烧杯、量筒、玻棒等。
实验操作程序
1.三龄幼虫的培养
为获得理想的染色体制片,需要选用生长良好、形体肥大的三龄幼虫,以保证唾腺发育良好。为此,果蝇幼虫的培养应注意以下几个方面:
(1)配制营养丰富的培养基
在配制培养基时,可适当增加水的用量或降低琼脂的比例,还可适当增加酵母粉的比例,这样配制的培养基营养丰富,含水量较高,发酵良好,比较松软,更适合幼虫生长。
(2)控制虫口密度
培养基的营养对幼虫发育固然重要,但适当的虫口密度是培养肥大幼虫的必要条件。可通过控制成虫数量和排卵时间来控制虫口密度。一般情况下,250mL培养瓶中转入成虫不宜超过10对,培养12h后将成虫全部移出。每平方厘米培养基中有20~30只幼虫为宜,可保证幼虫的良好生长发育。
(3)适当补加酵母液
一龄幼虫出现后,为使幼虫良好地生长发育,可在培养基表面适当补加一次2%~4.5%的低浓度酵母液;二至三龄幼虫期,再补加一次10%酵母液。每次补加量以覆盖培养基表面一薄层为宜。(https://www.daowen.com)
(4)低温培养
将培养箱温度控制在16~20℃之间,进行低温培养,以延长幼虫生长时间,使其生长发育更充分,这样可以培养出肥大的三龄幼虫。当三龄幼虫爬出培养基表面时,也可以将幼虫培养瓶转移至8~10℃的低温培养箱中,进行低温培养12h或24h,以使制片中染色体更易于分散。
2.唾腺染色体制片与观察
(1)唾腺的剖取
首先把载玻片放在实体解剖镜的载物台(最好用黑背景)上,选取肥大、行动迟缓、爬在瓶壁上的三龄幼虫,置于载玻片上,加几滴0.7%生理盐水(如幼虫带有培养基可先用生理盐水洗净)。果蝇唾腺位于幼虫体前1/4~1/3处,在解剖镜下仔细观察辨认幼虫的头部(带黑色口器的尖头端)和尾部后,左手持解剖针压住虫体中部,固定幼虫,右手持解剖针扎住头部,适当用力向外把虫体前端拉断。随着头部脱离身体,可将一对半透明、类似香蕉形的唾腺拉出,此时,食管和肠道也会同时拉出,常常与唾腺混绕在一起,需要仔细辨别。
唾腺为一对囊状结构,由单层细胞构成,位于食道两侧,有时成对黏在一起呈V字形(图3-4)。用解剖针把唾腺剔出移至干净处,清除其余的器官和组织,如果唾腺上附有泡状脂肪体,则应剔除干净。最后把唾腺移至载玻片干净的位置或另一干净的载玻片上。整个剖取过程需在生理盐水中进行。
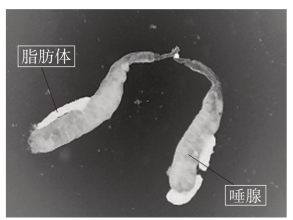
图3-4 D.virilis的唾腺形态
(2)解离
用滤纸吸去多余的生理盐水,然后在唾腺上加1滴1mol/L盐酸,室温下解离5~8min,使组织松软,便于压片,利于染色体分散和着色。
(3)水洗
用滤纸吸去盐酸后,滴加蒸馏水冲洗唾腺,吸干蒸馏水并重复几次。此操作过程要十分小心,吸水纸不要太靠近唾腺,谨防唾腺丢失。
(4)染色
在唾腺上加一滴改良苯酚品红染液,染色3~5min。染色的同时,可用镊子把唾腺稍稍捣碎。
(5)压片
染色完成后,用镊子取一干净盖玻片,使其一端浸入染液,然后以45°角缓缓落下,排净气泡,在盖玻片上覆两层吸水纸,用一只手的食指和拇指固定盖玻片位置,另一只手的拇指使劲按压。压片时载玻片平放于桌面,用力要适当,既要使染色体分散开,又不致将染色体压碎,还要防止压碎盖玻片或载玻片,同时注意不要来回搓动盖玻片,以免影响制片效果。
(6)镜检观察
将制好的压片先在低倍显微镜下观察,寻找染色体分散良好、形态适中的细胞移至视野中心,转到高倍镜下仔细观察。果蝇唾腺染色体有以下特点:巨大性、具有染色中心、体联会、每条染色体臂上有明暗相间的横纹和疏松区(泡)等。也可对照唾腺染色体模式图(图3-2),辨认从染色中心伸出的5条长臂和1条短臂(不易辨认)。
(7)永久片的制作
理想的临时制片,可以制成永久片。步骤如下:临时制片扣置于70%乙醇中(垫起载玻片的一端),待盖玻片脱落后,先经95%乙醇、无水乙醇脱水(各3~5min),再经二甲苯透明(3~5min),最后树胶封片。
预期实验结果与分析
在显微镜下可观察到,果蝇的唾腺呈半透明状态,由单层细胞构成,一个唾腺约几十个细胞。细胞形状不规则,轮廓清晰,细胞核较大。
黑果蝇的唾腺染色体形态及各条臂的特征如图3-5所示。黑果蝇的体细胞染色体数2n=12,全部为端部着丝粒染色体,其中有5条染色体臂较长,1条染色体臂很短,是点状染色体,附着在染色中心附近,不易观察到。另外,在染色体臂上有明显深浅不同、宽窄不一的带纹,在不同部位会观察到疏松区(泡)。

图3-5 D.virilis的唾腺染色体
黑腹果蝇共有4对染色体(2n=8)。果蝇的巨大染色体是从染色中心向周围放射状伸出的5条长臂和1条短臂(图3-2)。其中1号X染色体为端部着丝粒染色体,只有1条臂;2号和3号染色体为中部着丝粒染色体,在巨大染色体中各形成左、右两条臂,即ⅡL、ⅡR、ⅢL、ⅢR;4号染色体是很小的点状染色体,附着于染色中心边缘,不易观察到。巨大染色体每条臂上的横纹和疏松区都是特定的,且各不相同。因此可以根据这些特征辨认出每条染色体臂。
黑果蝇与黑腹果蝇相比,有更强的生活力和繁殖力,在实验室更易于培养,其三龄幼虫平均体长约为5mm,显著大于黑腹果蝇;黑果蝇唾腺周围的脂肪体较少,易于剔除,唾腺体积也明显大于黑腹果蝇,非常有利于初学者解剖观察。此外,黑果蝇的唾腺染色体容易伸展,条带宽平,横纹清晰,我们认为是比黑腹果蝇更为理想的一种唾腺染色体标本制作实验材料。
要点及注意事项
1.剖取的唾腺要尽可能完整,随时补加生理盐水,小心剔除脂肪。
2.用吸水纸吸去生理盐水和盐酸、冲洗染色时谨防唾腺丢失。
3.染色时间不宜过长,否则背景也着色,影响观察。
4.压片时用力要适当,不要来回搓动。
作业与思考题
1.果蝇的唾腺染色体有哪些主要特征?
2.果蝇唾腺染色体制片过程中应注意哪些问题?
3.试述果蝇唾腺染色体上带的形成及其在遗传研究中的意义。
参考文献
1.张根发.遗传学实验[M].北京:北京师范大学出版社,2010.
2.王金发,戚康标,何炎明.遗传学实验教程[M].北京:高等教育出版社,2008.
3.乔守怡.遗传学分析实验教程[M].北京:高等教育出版社,2008.
4.贺竹梅.现代遗传学教程[M].广州:中山大学出版社,2002.
5.戴灼华,韩文智.中国D.virilis果蝇唾腺染色体的初步观察[J].遗传,1986,8(2):23-24.
(牛炳韬)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






