固体与固体表面之间同样有吸附作用,但是两个表面必须接近到表面力作用的范围内(即原子间距范围内)。如将两根新拉制的玻璃丝相互接触,它们就会相互黏附,黏附功表示了黏附程度的大小,定义为
WAB=ГA+ГB-ГAB (7-52)
式中,WAB为黏附功;ГA,Гg分别为A,B两种固体物质的表面张力;ГAB为A、B两种物质形成新的界面时的界面张力。
若WAB=3×10﹣6J/cm2,当表面的有效距离为1nm时,则相当于黏结强度为30MPa。两种不同物质之间的黏附功往往超过其中较弱物质的黏结力。
表面污染会使固体表面之间的黏附力大大减小,这种污染往往是非常迅速的。例如,铁若在水银中断裂,两个裂开面可以再黏合起来,而在普通空气中就不行。因为铁迅速与氧气反应,形成一个化学吸附层。表面净化一般会提高黏结强度,但固体的吸附只有当固体的断面很小并且很清洁时才能表现出来。这是因为黏附力的作用范围仅限于分子间距,而任何固体表面从分子的尺度看总是粗糙的,因此,实际接触面积往往只占名义接触面积的极小部分。
由于吸附发生在固体的表面,所以固体的吸附性能与其表面能密切有关,不难想象,物质被粉碎成微粒后,其总表面积急剧增大。定义单位质量的吸附剂具有的表面积为比表面积,可按下式计算:
A0=A/W
式中,A0为物质的比表面积(m2/g);A为物质的总表面积(m2);W为物质的质量(g)。上式是比表面积是物质分散程度的一种表征方法。
提高固体比表面积从而提高固体的吸附能力的另一种方法是使固体具有许多内部空隙,即具有多孔性。例如常用的吸附剂硅胶、活性氧化铝、活性炭、分子筛等,都具有大小不等的内孔,使得其具有巨大的比表面积,从102~103(m2/g)。多孔性吸附剂孔径的大小及分布对其吸附性能有重要的影响,例如被吸附分子的尺寸与孔径的大小应相适应,被吸附分子进入较大的孔径容易,进入较小的孔就比较困难,这就使得某些吸附剂具有一定的选择性。吸附在脱水、脱气、净化、分离、催化等领域有广泛的应用,是化学工程的重要单元操作之一。
固-固界面现象与吸附作用这一中心问题密切相关。吸附过程对材料的最终物理化学和物理力学性能起着关键性的作用。黏合的形成以及其他许多应用过程,其第一阶段都是从吸附开始的。在黏附理论中吸附理论是最主要的理论。
吸附理论的基本观点是:黏合是一种吸附作用,这是最早提出并被大多数科学家接受的。经典的吸附理论主要特点有:
①原子分子的相互吸引与聚集,来源于1879年范德瓦尔斯提出的相互作用力。同一种黏合剂可以黏结很多种不同材料,说明这是一类具有广泛吸引作用力的作用,这就是吸附作用。
②DeBruyne很早就认为,分子间界面黏合力与体相内聚力,都是由次价键力包括范德瓦尔斯力和氢键力构成的,即物理吸附作用力。
③吸附理论是建立在热力学平衡概念上的。据此可推导出黏合功与内聚功。
④根据黏合功的计算,可以定量地比较不同黏合剂体系的理想黏结强度。而实际黏结强度要比理想黏结强度低1~2个数量级的原因,吸附理论也可以从界面缺陷、应力集中、裂纹、弹性应变能及塑性功等方面,作出科学解释。(www.daowen.com)
⑤润湿是影响黏结强度的重要因素,这也是吸附理论的内容。它论证了黏结强度受润湿能力和材料力学性质两方面的影响,以及黏合的最佳润湿条件和极性的关系。
现代吸附理论主要有两方面的观点。
1.黏合键生成的基本过程
Mclaren在早期提出的生成黏合键基本过程,有以下三点:①合剂溶液或熔体,通过大分子的宏观布朗运动,接近被黏物表面。②大分子链段通过微布朗运动,向被黏物表面进一步靠拢。加热、加压及黏合剂的低黏度,有利于微布朗运动。③当黏合剂与被黏物分子间的距离r,接近到小于0.5nm的程度时,即形成次价力的黏合键。
吸附理论的现代观点则认为:①黏合剂通过润湿作用,和被黏物在界面上实现分子接触;②大分子通过内旋转运动,建立最适合的构象,达到吸附平衡;③大分子或大分子的链段,由于吸附作用而进行跨越界面的扩散,形成扩散界面区;④分子间发生物理吸附或化学反应,形成跨越界面的次价力或化学主价力的黏合键。
此观点很重视扩散的影响,认为大分子或局部链段跨越界面的扩散程度,对黏结强度有显著影响;小量的浅层扩散,形成的界面是分明的;若分子间相互作用只有色散力存在,因色散力键能很小,必然表现出黏结强度低。要想提高强度,则应选择有强极性相互作用,或能与被黏物生成化学键的黏合剂。若因扩散程度很高,形成弥散型的界面,其间有大分子相互穿透或缠结,即使仅有色散力,也可产生高的黏结强度。现代吸附理论不拘一格,已吸取了与扩散理论和高分子物理有关的大分子运动基本概念,并加以发展。它把扩散看成是黏合过程必经的步骤,也是形成高黏结强度的必要条件。吸附与扩散原来是两种理论,而今相互接受、相互沟通、相互补充。
2.分子间相互作用的加和性
认为界面上的总吸引能,可以由各种分子间作用能的加和而得。Fowkes用黏合功W12表示相互作用的强弱,则W12等于界面上各种作用力对黏合功作贡献的加和,即
式中,右上标d,p,h分别代表色散力、极性力和氢键力;右下标12表示界面上1、2两个相。
由于在液相和固相中,偶极力作用极小,亦即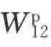 的贡献很小,因此可以忽略。Fowkes又根据原子的电子受体与给体,建立了酸、碱相互作用的概念。这即是广义的Lewis酸(电子受体)及Lewis碱(电子给体)。氢键作用只是酸碱相作用中的一种,用酸碱相互作用的黏合功
的贡献很小,因此可以忽略。Fowkes又根据原子的电子受体与给体,建立了酸、碱相互作用的概念。这即是广义的Lewis酸(电子受体)及Lewis碱(电子给体)。氢键作用只是酸碱相作用中的一种,用酸碱相互作用的黏合功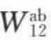 ,即包含了
,即包含了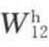 ,于是式(7-53)可简化为
,于是式(7-53)可简化为
式中,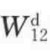 为以色散力为主的物理吸附;
为以色散力为主的物理吸附;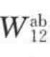 为化学吸附。
为化学吸附。
W12还可写成
W12=Г2(1+cosθ12) (7-55)
通过实验可测知Г2,θ,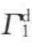 及
及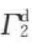 诸值,于是通过式(7-56)可求出
诸值,于是通过式(7-56)可求出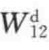 ;联立式(7-54)、式(7-55)、式(7-56)三式可求出
;联立式(7-54)、式(7-55)、式(7-56)三式可求出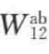 。这样,界面上的黏合功就可通过相互作用力的加和而得到。
。这样,界面上的黏合功就可通过相互作用力的加和而得到。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






