离子键指阴离子、阳离子间通过静电作用形成的化学键,通过两个或多个原子,或者化学集团失去或获得电子而成为离子后形成。带相反电荷的离子之间存在静电作用,当两个带相反电荷的离子靠近时,表现为相互吸引,而电子和电子、原子核与原子核之间又存在着静电排斥作用,当静电吸引与静电排斥作用达到平衡时,便形成离子键。因此,离子键是阳离子和阴离子之间由于静电作用所形成的化学键。此类化学键往往在金属与非金属间形成。失去电子的往往是金属元素的原子,而获得电子的往往是非金属元素的原子。通常,活泼金属与活泼非金属形成离子键,如钾、钠、钙等金属和氯、溴等非金属化合时,都能形成离子键。
离子键是由电子转移(失去电子者为阳离子,获得电子者为阴离子)形成的,即正离子和负离子之间由于静电引力所形成的化学键。离子既可以是单离子,如Na﹢,Cl﹣;也可以由原子团形成,如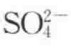 ,
, 等。研究认为,在分子或晶体中的原子并不是简单地堆砌在一起,而是存在着强烈的相互作用。化学上把这种分子或晶体中原子间(有时原子得失电子转变成离子)的强烈作用力叫作化学键。键的实质是一种力,所以有的又叫键力,或就叫键。以钠与氯化合生成氯化钠为例:从原子结构看,钠原子最外电子层上有1个电子,容易失去;氯原子在外电子层有7个电子容易得到1个电子。当钠原子与氯原子相遇时,钠原子失去最外层的一个电子,成为钠离子,带正电,氯原子得到钠失去的电子,成为带负电的氯离子,阴阳离子的异性电荷的吸引作用,与原子核之间、电子之间的排斥作用达到平衡,形成了稳定的离子键。
等。研究认为,在分子或晶体中的原子并不是简单地堆砌在一起,而是存在着强烈的相互作用。化学上把这种分子或晶体中原子间(有时原子得失电子转变成离子)的强烈作用力叫作化学键。键的实质是一种力,所以有的又叫键力,或就叫键。以钠与氯化合生成氯化钠为例:从原子结构看,钠原子最外电子层上有1个电子,容易失去;氯原子在外电子层有7个电子容易得到1个电子。当钠原子与氯原子相遇时,钠原子失去最外层的一个电子,成为钠离子,带正电,氯原子得到钠失去的电子,成为带负电的氯离子,阴阳离子的异性电荷的吸引作用,与原子核之间、电子之间的排斥作用达到平衡,形成了稳定的离子键。
离子键的作用力强,无饱和性,无方向性。离子键存在于离子化合物中,离子化合物在室温下是以晶体形式存在。离子键较氢键强,其强度与共价键接近。离子键的键能比较大,反映在离子化合物中就是高熔沸点,离子键的键能被称作晶格能,晶格能的符号与离子晶体解离过程焓变的符号保持一致。晶格能可以通过玻恩-哈勃循环(Bōrn-Haber cycle)或玻恩-兰德公式(Bōrn-Landé)计算得出,也可以通过实验测量。
以含羧基的胶剂为例,在粘接金属时,可能与金属表面上的氧化膜Me﹢O﹣有下列反应:
如果不慎使玻璃瓶口与玻璃塞之间碰到含Ca(OH)2的溶液,也会引起离子键型的粘接,即
在离子型化合物中,正、负离子间的相互吸引力为
式中,Q1,Q2分别为正负离子所带的电量;R为正、负离子间的距离。当距离足够小时,由于正、负离子内的电子云靠近而开始产生斥力作用。若正、负离子处于一定距离而使以上两力达到平衡时,即引力与斥力大小相等,则体系的势能最低。引力与斥力大小相等,则体系的势能最低。如果正、负离子间距离被拉伸到比平衡时的大,合力随距离的增加会达到一极大值,然后逐渐减少,最后趋近于零。外力将组成分子的离子(或原子)推到无穷远所需做的功为D,它是该化学键的解离能或称键能,一般常用D值表征结合力。
倘若要估算结合力的大小,可以从常态晶体化合物的讨论开始。假如以氯化钠离子晶格为例,它是立方点阵,每一个离子都有6个和其电荷相反的相邻离子配位,即在NaCl点阵中的配位数是6。稍远一点,与中心离子相距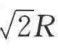 处,有12个带相同电荷的离子。再远一点就是8个带相反电荷的离子,中心离子与它们的距离是
处,有12个带相同电荷的离子。再远一点就是8个带相反电荷的离子,中心离子与它们的距离是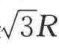 等。因此一个离子和它周围离子间的静电相互作用可以表示为
等。因此一个离子和它周围离子间的静电相互作用可以表示为
式中,A为Madelung常数。
对配位数为6的NaCl晶体来说
由正、负离子电子云所引起的斥力势能,同样也可以表示为紧邻离子间距离的函数。因为它只在短距离内起作用,且随着距离的增大而迅速地减弱,于是能以B/Rn表示。其中B和n都是常数,n称Bōrn指数,在一般情况下为5~12之间,但随离子中电子个数的增多而增大。
在NaCl中,Na﹢的电子层结构与Ne类同,n Na﹢=7,而C1﹣的电子层结构类同于Ar, ncl﹣=9,因此,Na Cl的n取平均值为8,于是NaCl点阵的总势能(Na﹢和C1﹣的带电荷数Z﹢和Z_都等于1)可以表示为
B可以由平衡状态的U为极小值时确定,即将U对R微分,且令其导数为零。
此式的n值可由晶体的压缩系数求得,R0是从X射线谱和电子光谱求得。按上式求得NaCl的离子晶体的点阵能(又称晶格能,是总势能的负值)为753kJ/mol。(https://www.daowen.com)
由式(7-26)对R微分,可求得离子间作用力F与离子间距离R的关系,即
当F达到极大值时,则R=R1,因此
将式(7-28)代入式(7-27),得
从式(7-25)和式(7-28)可知:
由此而得:
于是
如将式(7-26)变为
则式(7-31)也可变为
上述推导所得公式是有关离子晶体(电荷数1-1型)点阵的势能和最大作用力的理论计算式。
根据以上的推导方法,对于游离的气体离子型分子,例如Na﹢Cl﹣,由于只有两个相邻的异电性离子,则Madelung常数A应等于1,其势能为
其中理论上导出的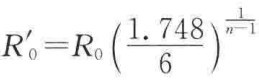 ,则
,则
由式(7-33)和式(7-35)算出的NaCl游离气体型分子的键能U′0为513.5kJ/mol。要使两离子分离所需的最大力FR′=R′1=2.085×10﹣9N。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。








