吸附作用通常是放热的,吸附热是指吸附过程产生的热效应。在吸附过程中,气体分子移向固体表面,其分子运动速度会大大降低,因此释放出热量。物理吸附的吸附热等于吸附质的凝缩热与湿润热之和。当前者相对于后者很大时,可忽略湿润热。物理吸附的吸附热一般为40kJ/mol左右。化学吸附过程的吸附热比物理吸附过程的大,其吸附热数值与化学反应热的数量级相同(吸附热在80kJ/mol以上),可以看成是表面化学反应。化学吸附热应等于脱附(或反向反应)活化能与化学吸附活化能的差值。习惯上,将放热的化学吸附热取正值。吸附温度也会影响吸附热的大小。在实际操作中,吸附热会导致吸附层温度升高,进而使吸附剂平均活性下降。化学吸附速率一般较小,在低温下不易达到平衡。吸附过程产生的热为吸附热,吸附热的大小可以衡量吸附强弱的程度,吸附热越大,吸附越强。物理吸附没有选择性,吸附热小,吸附不稳定容易解析,化学吸附相反。
气体与固体表面的吸附平衡时,可以应用如下的Clausius-Clapeyron方程来计算吸附热。
式中,p是吸附平衡中的气体压力;△H应以吸附焓变来代替。由于吸附焓变一般不是常数,它依赖于表面覆盖度θ(吸附量与单分子层饱和吸附量之比,θ可能大于1,表明吸附可能有多分子层),因此,上述的方程式必须修改为在指定覆盖度θ下吸附气体的平衡压力与温度的关系式,即
式中,△HV为指定θ下的等量吸附焓变。
等量吸附热为
Qe=﹣△HV (6-47)
式(6-47)积分后为:
按上式要求,可以利用两个温度下测量所得的吸附等温线或两个压力下的吸附等压线,取得两个相对应的p和T数据,代入等量吸附方程方可求出Qe。
吸附热的测试方法有:①直接量热法,即用量热计测量已知气体在一定量固体表面上吸附所引起的温度升高,根据热容可以计算出吸附热;②气相色谱法,即以吸附剂为固定相,根据被测气体的相对保留时间或者保留体积计算吸附热。
吸附量的测量一般是在一定温度下将吸附剂放在气体环境中,分别测出不同吸附平衡分压及其对应的吸附量,就可以得到吸附等温曲线。根据测得的吸附量,应用Gibbs方程了解因吸附引起的界面能的变化及吸附分子的状态。
实际界面是成分和性质不均匀的相间过渡区域,在界面中不同的位置,界面浓度就不相同,因而确定界面浓度与体相浓度之差(吸附量)十分困难。Gibbs将界面相视为一几何面,认为此面两侧两相的组成和性质都是均匀的,并规定在此位置上某一组分的表面过剩量为零。换言之,即认为表面过剩量为零的这一组分在界面上和体相内的浓度相等。此面一经确定,即可计算其他组分表面过剩量(即吸附量)。
由恒温、恒压条件下表面热力学数量的变化可得到Gibbs吸附方程的基本形式:(https://www.daowen.com)
式中,Γ为表面张力;A为表面积;ni为i组分的表面物质的量;μi为i组分的化学势;λi为单位表面上i组分的过剩量,即表面吸附量。将式(6-49)展开得
﹣dГ=λ1dμ1+λ2dμ2+λ3dμ3+⋯ (6-50)
采用Gibbs的规定,即使组分1的表面过剩量λ1=0,则
dГ=∑λi(1)dμi (6-51)
对于理想溶液和理想气体,有
μi=RTlnci=RTlnpi (6-52)
对于双组分体系,若第一组分为主要组分,且设λ1=0,第二组分的吸附量写作λ2(1),则由以上两式可得
λ2的常用单位是mol/m2。由以上两式可知,当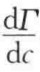 或
或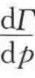 <0时,
<0时,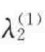 >0,即为正吸附当
>0,即为正吸附当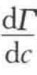 >0时,λ2(1)<0,即为负吸附。
>0时,λ2(1)<0,即为负吸附。
对于稀溶液和单组分气体的吸附,可以认为表面过剩量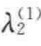 即为实际测出的吸附量,因此以上两式中的
即为实际测出的吸附量,因此以上两式中的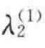 用λ表示,式中的c2和p2分别用c和p来代替。
用λ表示,式中的c2和p2分别用c和p来代替。
吸附相平衡是吸附分离科学技术的重要基础之一,决定了吸附剂对吸附质分子的最大吸附容量以及吸附选择性。吸附等温曲线是吸附相平衡的具体描述,是吸附分离装置设计所必需的参数。通过对一系列吸附等温曲线的分类,人们可以更好地理解各种吸附机理并建立相应的理论模型。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。






