1.离子吸附与双电层
当固体与电解质溶液接触时,由于溶液中各组分在溶液相和固-液界面相中的化学势不同,会发生离子的迁移和吸附,使固体表面带有某种电荷。此外,有些固体表面本身带有可离解基团,当介质的pH值变化时,这些表面基团会发生不同程度的解离,导致表面荷电,溶液中与固体表面荷电符号相反的离子必将靠近固-液界面而形成双电层(doublelayer)。
以AgNO3与过量的KCl在溶液中形成AgCl晶体为例,由于KCl过量,生成的AgCl处于K﹢,Cl﹣, 的离子溶液中。由Fajans-Paneth规则可知,能与晶体离子生成难溶化合物的离子优先被晶体吸附,故而Cl﹣会被AgCl晶体吸附并形成牢固的化学结合,使表面带负电荷。多余的K﹢靠静电引力趋向表面,热扩散运动又使其在溶液中呈均匀分布,从而使得固体表面附近的K﹢浓度较大,而在远离表面处,K﹢和Cl﹣的浓度基本相等,如图5-16所示。从图中可以看出,靠近表面一两个分子厚的区域内反离子(K﹢)与表面结合成牢固的固定吸附层,称为Stern层,反离子电性中心的连线构成Stern平面(图中的d面)。Stern面与溶液内部的电势差为Stern电势,以
的离子溶液中。由Fajans-Paneth规则可知,能与晶体离子生成难溶化合物的离子优先被晶体吸附,故而Cl﹣会被AgCl晶体吸附并形成牢固的化学结合,使表面带负电荷。多余的K﹢靠静电引力趋向表面,热扩散运动又使其在溶液中呈均匀分布,从而使得固体表面附近的K﹢浓度较大,而在远离表面处,K﹢和Cl﹣的浓度基本相等,如图5-16所示。从图中可以看出,靠近表面一两个分子厚的区域内反离子(K﹢)与表面结合成牢固的固定吸附层,称为Stern层,反离子电性中心的连线构成Stern平面(图中的d面)。Stern面与溶液内部的电势差为Stern电势,以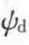 表示。Stern层之外为扩散层。在外力作用下固体与液体相对移动时随固体一起运动的滑动面(δ面)与溶液内部之电势差称为电动电势或ξ电势。显然,在滑动面内除了Stern层离子外,还有一定的溶剂分子,故δ面在d面之外。从图5-16可以看出,电势值与吸附层未能抵消的表面电荷数目及扩散层中的离子数有关。
表示。Stern层之外为扩散层。在外力作用下固体与液体相对移动时随固体一起运动的滑动面(δ面)与溶液内部之电势差称为电动电势或ξ电势。显然,在滑动面内除了Stern层离子外,还有一定的溶剂分子,故δ面在d面之外。从图5-16可以看出,电势值与吸附层未能抵消的表面电荷数目及扩散层中的离子数有关。
双电层厚度会随着电解质的加入而发生变化。这是由于加入电解质会使扩散层与体相溶液间的浓度差减小,反离子向体相溶液的扩散通量减少,更多的反离子进入固定层,从而使ξ电势下降(见图5-17)。处于扩散层中的离子,可被加入溶液中的同性离子取代(离子交换)。通常,离子半径大而水化体积小的离子,比半径小而水化体积大的离子能较强地吸向表面。这种离子交换也将导致双电层减小和ξ电势下降。高价离子不仅能降低ξ电势,而且有可能改变表面带电的符号。这是由于高价反离子具有特别强的吸附能力,在表面上有可能超量吸附。例如,在水中的玻璃表面因其表面基团的解离而带负电荷,反离子Na﹢的存在形成正常的扩散双电层(见图5-18(a))。加入的高价Al3﹢会与Na﹢交换,不仅可使扩散层中的Na﹢减少,而且Al3﹢可进一步交换固定层中的Na﹢,这种超量吸附的结果使表面正电荷过剩,从而使玻璃表面Stern层带正电,阴离子成为反离子,形成新的双电层(见图5-18(b))。这时,虽然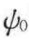 保持不变,但
保持不变,但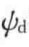 和ξ电势均变为正。
和ξ电势均变为正。
图5-16 双电层结构示意图
图5-17 离子浓度对双电层的影响
图5-18 水中的玻璃表面的双电层结构
2.电解质离子在固-液界面上的吸附
大多数情况下,电解质的一种离子被吸附,另一种符号相反的离子形成扩散层。因此,电解质的吸附大致有三种情况:①某种离子强烈吸附构成Stern层;②与扩散层中的离子交换后被吸附;③两亲性大离子的吸附可由静电力或疏水相互作用所致。
(1)Stern层吸附某些离子可依靠强烈的静电引力作用吸附到固-液界面上构成Stern面,可用Langmuir等温式描述:(www.daowen.com)
式中,θ为覆盖率;c为离子的平衡浓度;z为离子价数;e为单位电荷;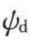 为Stern面电势;Φ为吸附势。式(5-24)表明,吸附量不仅与静电作用有关,还受到吸附势能的影响。大多数情况下,静电作用的影响更大,表5-6列出了离子价数不同的阴离子对带正电的Al2O3溶胶的聚沉值及吸附量,结果表明,离子价数越高,静电作用越强,吸附量也越大,聚沉能力越强(聚沉值越小)。
为Stern面电势;Φ为吸附势。式(5-24)表明,吸附量不仅与静电作用有关,还受到吸附势能的影响。大多数情况下,静电作用的影响更大,表5-6列出了离子价数不同的阴离子对带正电的Al2O3溶胶的聚沉值及吸附量,结果表明,离子价数越高,静电作用越强,吸附量也越大,聚沉能力越强(聚沉值越小)。
表5-6 Al2O3溶胶的聚沉值与吸附量
(2)离子交换吸附硅铝酸盐类黏土等天然的或合成的无机固体以及一些合成的有机聚合物固体晶格上束缚的某些离子,可与溶液中的同性离子发生等当量交换反应,即为离子交换,如下式所示:
M1+RM2M2+RMl (5-25)
此过程的平衡常数为
式中,M1为溶液中的可交换离子;RM2为带有可交换离子M2的固体(离子交换剂)。通常离子交换剂多具有网状结构,含有交换离子的溶液可在其中自由流动。例如,在以硅铝酸盐为主要成分的沸石中,Na﹢可被其他离子交换。根据交换离子的性质,离子交换剂分为阳离子型和阴离子型两大类。阳离子型的典型活性基团有RCOOH,ROH,RSO3H等,阴离子型的有RNH2,RNH等。离子交换的难易程度取决于平衡常数K的大小。当式(5-25)中M1为H﹢时,碱土金属离子交换H﹢的能力可用25℃时的﹣RTln K做比较,此值即为交换H﹢的标准Gibbs自由焓变﹣ ,显然﹣
,显然﹣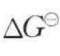 值越大,交换越容易进行。表5-7列出了25℃碱土金属离子与H﹢交换的﹣
值越大,交换越容易进行。表5-7列出了25℃碱土金属离子与H﹢交换的﹣ 值。
值。
表5-7 Al2O3溶胶的聚沉值与吸附量
离子交换剂的基本特性称为交换容量或交换能力,量纲为mmol/g。交换容量的大小受交换剂上活性基团的数目及解离度,溶液中交换离子的价数、浓度、离子半径大小、水化能力等因素的影响。离子交换已被广泛应用于化工、冶金、生物医药、食品等许多领域。例如,利用含磺酸基的交联聚苯乙烯树脂可分离所有的稀土元素,含羟基和磺酸基的酚醛树脂可分离蛋白质水解产生的二十几种氨基酸。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







