从实用角度而言,绝大多数固-液吸附应用实例与稀溶液相关联。当溶质浓度较小时,实验所测定的表观吸附量即为真实吸附量。本节将讨论稀溶液吸附等温线及其影响因素。
1.吸附等温线方程
稀溶液中吸附的等温线通常可用Langmuir方程或Freundlich方程进行描述。
假设溶液中溶质和溶剂分子吸附在固体表面上占有同样大的面积,吸附可视为如下的平衡过程:
式中,1为溶剂,2为溶质,L为液相;S为吸附相。该过程的平衡常数为
式中,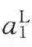 和
和 是溶剂和溶质在液相中的活度;
是溶剂和溶质在液相中的活度;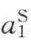 和
和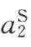 是溶剂和溶质在表面相(吸附相)的活度,由于固相内各组分的活度系数近似为1,其活度之比等于物质的量之比,即
是溶剂和溶质在表面相(吸附相)的活度,由于固相内各组分的活度系数近似为1,其活度之比等于物质的量之比,即
对于稀溶液,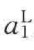 近似为常数。溶质的活度系数近似为1,即令
近似为常数。溶质的活度系数近似为1,即令
将式(5- 17)~式(5-19)代入式(5-16),经整理后可得
该式即为Langmuir吸附等温线方程。将其线性化可得
根据式(5-21),以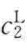 /
/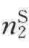 对
对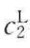 作图可得直线,由该直线斜率和截距可求出ns和b的值。
作图可得直线,由该直线斜率和截距可求出ns和b的值。
Langmuir在推导该式时,假设被吸附分子间无相互作用,且为单分子层吸附。式(5-20)所代表的稀溶液吸附过程是溶质、溶剂、吸附剂综合作用的结果,而且固体表面几乎不可能完全覆盖均匀,吸附相也很难是完全理想的,因稀溶液吸附的Langmuir方程具有经验公式的性质。
对于不均匀表面,b不是常数,而是随吸附度而变,可用如下的Freundlich方程进行描述:
式中,K和n为常数,n>1。将式(5-22)线性化可得
根据式(5-23),以lg(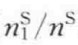 )对
)对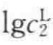 作图可得直线,由该直线斜率和截距可求出K和n的值。
作图可得直线,由该直线斜率和截距可求出K和n的值。
由式(5-23)可知,在有限的浓度范围内,若实验数据符合Freundlich方程,则表明固体表面是不均匀的。
2.吸附等温线的种类(https://www.daowen.com)
稀溶液中的吸附等温线大致分为4类:S型、L型、H型和C型,如图5-12所示。下面分别加以介绍。
图5-12 吸附等温线的四种类型
S型等温线的特点是起始部分斜率小,并凸向浓度轴。当溶剂有强烈的竞争吸附,且溶质以单一端基近似垂直定向地吸附于固体表面时,可出现这类等温线。随着平衡浓度的增大,吸附量有一较快上升阶段,这是被吸附的溶质分子与液相中溶质分子相互吸引的结果。
L型等温线(Langmuir型)的特点是吸附量与浓度的关系符合Langmuir方程。一般来说,这种类型表示在稀溶液中溶质比溶剂更易被吸附。溶质是线性的或平面分子,且以其长轴或平面平行于表面的吸附常有这类等温线。
H型等温线(Highaffinity型)的特点是溶质在极低浓度时就有很大的吸附量,表示溶质与吸附剂间有强烈的亲和力,类似于化学反应。例如,自溶液中的化学吸附、离子交换吸附、高分子吸附和某些离子型表面活性剂胶团的吸附都属于此类。
C型等温线(Constantpartition型)的特点是起始段为一直线,表示溶质在吸附剂表面相和溶液中的分配是恒定的。某些物质在部分结晶聚合物上的吸附有时出现这类等温线,其机理可能是吸附质最初吸附在无定形区内,由于吸附的作用使其他部分发生膨胀形成新的吸附位,从而可继续发生吸附,直至结晶区,吸附作用不再继续进行。
从图5-12中可以看出,随着平衡浓度升高,吸附量都会出现一段增量趋缓的部分,表明此时固体表面已趋近单层饱和吸附;浓度再增加时,吸附量又会升高,这可能使吸附分子形成更紧密的排列或有多层吸附发生。对于在高浓度时有些吸附等温线有最高点的现象,可能是由于在此浓度后吸附质与固体表面亲和力不强,转而与溶剂中的溶质缔合,或者由于溶质活度随浓度变化的过程中出现了最大值。
3.稀溶液吸附的影响因素
(1)物质种类的影响。固-液吸附平衡是吸附质在液相和固相之间分配达到平衡的过程,吸附量的大小由吸附质、溶剂和吸附剂的性质决定。一般来说,极性物质较易进入极性较大的相,即极性吸附剂更易吸附溶液中的极性组分,非极性吸附剂更易吸附溶液中的非极性组分。据此,Freundlich提出了Traube规则:固体吸附水溶液中的有机同系物时,吸附量随有机物碳链增长而有规律地迅速增加。例如活性炭吸附水溶液中低级脂肪酸时(见图5-13),吸附量的变化规律是:丁酸>丙酸>乙酸>甲酸。
图5-13 活性炭吸附水溶液中低级脂肪酸
图5-14 硅胶吸附四氯化碳溶液中低级脂肪醇
另外,若用极性固体吸附非极性溶剂中的组分时,吸附量的变化规律正好相反,这种规律又称反Traube规则,如图5-14所示。实际上影响同系物吸附规律的因素还有许多,如溶剂的类型、溶液浓度、吸附剂制备和活化条件等。
(2)温度和溶解度的影响。一般来说,温度越高,吸附量越小;溶解度越大,吸附量越小。温度和溶解度对吸附的影响通常是一致的,即温度升高、溶解度增加都会降低吸附量,而温度升高又通常使溶解度增加。如图5-15(a)所示的炭黑吸附水溶液中脂肪酸的吸附等温线。为了弄清溶解度对吸附的影响,可考察吸附量与相对浓度c/c0(c0为饱和溶液浓度)的吸附等温线,如图5-15(b)所示,图中各脂肪酸的吸附等温线几乎重合,表明对该体系而言,溶解度是影响吸附的主要因素,也可以理解为温度升高所导致的吸附量降低完全是由于溶解度增加而引起的。
图5-15 炭黑吸附水溶液中脂肪酸的吸附等温线
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。





