在挤出过程中,SP-C分子α-螺旋结构的再定位,促使系统能量发生变化,从而促进DPPG成分的挤出。本节将以模型挤出开始时刻(图4-19中的Ⅱ)和挤出终止时刻(图4-19中的Ⅳ)为研究对象,计算挤出过程中系统能量的变化。设在挤出过程中,一个SP-C分子伴随有n个DPPG分子被挤出,挤出过程中能量的变化主要由以下六部分组成。
(1)DPPG分子与SP-C分子间相互作用所引起的磷脂-蛋白质相互作用能变△Elpi;
(2)SP-C分子构象变化引起的构象能变△Econ;
(3)SP-C分子α-螺旋结构与水分子接触面积的改变所引起的界面自由能变△Eint;
(4)SP-C分子α-螺旋结构挤出引起的扩散自由能变△Eexp;
(5)一个DPPG分子被挤出所需的能变△Elip,n个DPPG分子被挤出的总能变为n△lip;
(6)系统散热△Edis。
根据热力学第一定律,有
△Econ+△Eint+△Eexp+n△Elip+△Elpi=△Edis (4-13)
下面分别对式(4-13)中各项加以分析。
1.挤出过程中的系统散热△Edis
假设整个过程为绝热理想变化过程,散热可忽略不计,即
△Edis=0 (4-14)
2.磷脂-蛋白质相互作用能变△E1ip
在挤出过程开始时(图4-19中的Ⅱ),SP-C螺旋结构在单分子膜上与界面的倾角为20°左右,所以螺旋结构几乎淹没于磷脂分子的疏水尾链中。在这一步,磷脂-蛋白质相互作用能Elpi-1对系统的能量平衡做出重要的贡献。同样地,在挤出过程的末端时(图4-19中间的相互作用关系非常复杂,我们假定Elpi-1与Elpi-2之间的差异可以忽略不计。因此,△Elpi的Ⅵ),磷脂-蛋白质相互作用能Elpi-2对系统的能量平衡起到重要作用。鉴于磷脂-蛋白质Elpi-2-Elpi-1=0,式(4-13)简化为
△Econ+△Eint+△Eexp﹣n Elip (4-15)
3.构象能变△Econ
根据上述行为模型四点假设可知,在挤出及插入过程中α-螺旋结构的角度发生变化, SP-C的Pro-7残基构象存在正反式构象间的变换。根据蛋白质、多肽的构象能公式:
式中,φ,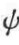 为旋转角;k,l为单个原子标号;
为旋转角;k,l为单个原子标号;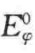 ,
,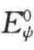 为扭转能垒;Ekl为非键合相互作用能;Ec为相邻的一对酰胺基之间的库仑作用力。设SP-C在单分子膜上时Pro-7的内旋转角为φ1,
为扭转能垒;Ekl为非键合相互作用能;Ec为相邻的一对酰胺基之间的库仑作用力。设SP-C在单分子膜上时Pro-7的内旋转角为φ1, ,挤出后旋转角为φ2,φ2。则构想能变为
,挤出后旋转角为φ2,φ2。则构想能变为
如果将△Ekl(φ, )与△Ec忽略不计,式(6-4)简化为(https://www.daowen.com)
)与△Ec忽略不计,式(6-4)简化为(https://www.daowen.com)
4.界面自由能变△Eint
界面自由能变是由SP-C的α-螺旋结构在单分子膜表面与水分子相接触所引起的界面自由能变。挤出前,存在一部分疏水性α-螺旋结构与水接触,这种不利于能量平衡的结构是通过烃层内的疏水作用和电荷-镜像电荷相斥作用而达到稳定的。挤出后,α-螺旋结构全部被磷脂疏水层包围。因此,整个过程引起界面自由能变。设SP-C分子α-螺旋结构与水接触的面积变化为△AC/W,挤出时膜的表面张力为ΓC/W,可得
△Eint=﹣ГC/W△AC/W (4-19)
5.扩散自由能变△Eexp
扩散自由能变是由于SP-C分子α-螺旋结构挤出后,单分子膜上原先由螺旋结构占据的水面被磷脂分子取代,从而引起自由扩散能变。设水面变化面积为△Awater,SP-C分子α-螺旋结构与水面夹角为20°,其在膜上的最大横截面积为Amax,单分子膜处于恒定的温度T和挤出表面压πsqu下,△Eexp由下式估算:
△Eexp=△U ﹣π△A+T△S (4-20)
式中,△S为熵变值,利用Maxwell关系式可得
将式(4-21)代入式(4-20),整理得
式中,△Awater可近似由下式求得:
△Awater=Amaxcos20° (4-23)
对DPPC单分子膜进行实验可得
6.挤出n个DPPG所需的能量n△Elip
设在挤出过程中,一个磷脂平均分子面积为Alip,挤出时表面张力为Γsqu,表面压为πsqu,纯水的表面张力为Γ0,则
△Elip=Ailp(Γ0-Γsqu)=Ailpπsqu (4-25)
将式(4-18)、式(4-19)、式(4-22)、式(4-25)代入式(4-15),整理得:
为了简化式(4-26),可假定TC/w为50mN/m,Alip为45 ;脯氨酸的顺反异构自由能的能量变化在1~7kcal/mol之间,取均值为3.5kcal/mol。SP-C的α-螺旋结构长度与直径分别为37
;脯氨酸的顺反异构自由能的能量变化在1~7kcal/mol之间,取均值为3.5kcal/mol。SP-C的α-螺旋结构长度与直径分别为37 和5
和5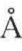 ,故Amax约为185
,故Amax约为185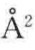 。假设在单分子膜上,α-螺旋的氮末端全部浸在水中,螺旋结构与界面的夹角为20°,α-螺旋结构浸在水中部分的长度约为13.7
。假设在单分子膜上,α-螺旋的氮末端全部浸在水中,螺旋结构与界面的夹角为20°,α-螺旋结构浸在水中部分的长度约为13.7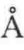 ,则△AC/w为107
,则△AC/w为107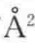 。将上述数据代入式(4-26),可得
。将上述数据代入式(4-26),可得
式中,πsqu的单位为mN/m;T的单位为K。
式(4-27)可用来估算在肺泡单分子膜挤出过程中,伴随一个SP-C分子挤出,DPPG分子挤出的个数。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







