1.非电解质水溶液的表面吸附
所谓吸附等温线,是指在一定温度下吸附量对浓度的函数关系曲线。一般表面活性物质在溶液表面的吸附等温线,都具有如图2-15所示的形式,这与Langmuir在研究固体表面吸附气体时提出的单分子层吸附等温线的形式相同。一般可用经验公式(2-45)表示:
式中,c为溶质浓度;b和a为经验参数。
式(2-45)由Szyszkowski提出,又称为Szyszkowski方程。将Gibbs吸附等温线方程与Szyszkowski方程结合,可得
这是典型的Langmuir型等温线公式。当浓度很小时(c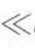 a),吸附量随浓度增大而直线上升,当浓度很大时(c
a),吸附量随浓度增大而直线上升,当浓度很大时(c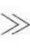 a),吸附趋向饱和值Гm,且有
a),吸附趋向饱和值Гm,且有
虽然Gibbs吸附等温线方程与Szyszkowski方程联合应用于溶液表面吸附时,导出了Langmuir型等温线方程,但这并不表明溶液表面吸附必定是单分子层吸附。事实上,已有人提出多分子层吸附是可能的。不过,在多数情况下,溶液表面吸附仍可近似为单分子层。这一点可由溶质分子在表面上平均占有面积的数据加以说明。(www.daowen.com)
由于Gibbs吸附量是表面过剩量,在计算分子平均占有面积时,应包括吸附分子和构成表面本底浓度的分子数。但是,当溶液浓度很小时,它所引起的溶质在表面层中的本底浓度比吸附量要小得多,可将Γ看作表面浓度,平均分子面积为
式中,Nav为阿伏伽德罗常数。一般表面活性剂溶液都属于这种情况。
2.电解质溶液表面的吸附
电解质水溶液的表面吸附问题要复杂得多,因为溶液中必然存在多个吸附品种,包括构成电解质解离平衡的离子和分子,水解离出的H﹢和O)H﹣及可能存在的水解产物。因此,研究电解质溶液表面吸附时,须分不同情况考虑多品种的吸附平衡及与其他平衡间的关系,详细内容可参考有关专著。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。







